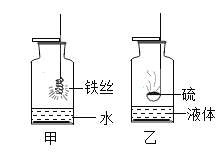
题目内容
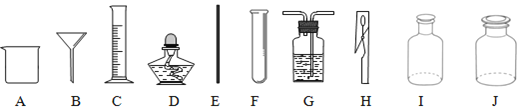
【题目】同学们需要配制50g溶质质量分数为15%的氯化钠溶液,如图为实验操作过程:
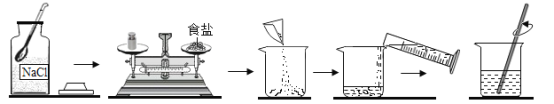
(1)称量氯化钠时,若按如图操作,天平平衡时,实际称得的药品质量________(填“偏大”“偏小”“不变”)。
(2)按正确操作称量氯化钠时,发现指针偏向右,应如何操作______(填字母)。
A减少砝码 B增加食盐 C调节平衡螺母
(3)在本实验中,应选择________(填“20”“50”“100”)![]() 的量筒。
的量筒。
(4)配制出来的NaCl溶液溶质质量分数偏小,其原因可能有_______(填序号)。
①氯化钠固体不纯
②称好的食盐有部分洒落到烧杯外
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
【答案】偏小 B 50 ①②③
【解析】
配制50g、15%的氯化钠溶液,则需要称量氯化钠的质量为:50g×15%=7.5g,需要量取水的体积为:(50g-7.5g)÷1g/cm3=42.5mL。
(1)根据天平的原理可知,M左=M右+M游。托盘天平的正确操作是左盘放物品,右盘放砝码。所以应该准备7g的砝码,并移动游码至0.5g。根据图示可知,左盘放砝码,右盘放物品。则实际的质量关系为:M砝码=M氯化钠+M游码,即7g= M氯化钠+0.5g,则称量的氯化钠的质量为6.5g,小于所需要的7.5g。故答案为:偏小;
(2)按照正确操作时,发现指针偏右,则说明天平左盘的氯化钠的质量不足所需要的7.5g,则应该继续添加食盐。故答案为:B;
(3)根据分析可知,实验需要42.5mL的水,则量筒应该选择略大于实际所需体积的量程,即50mL量筒。故答案为:50;
(4)①氯化钠不纯,则会导致称量的氯化钠的实际质量不足7.5g,从而使溶质的质量减小,从而使溶质的质量分数减小。①正确;
②称好的食盐有部分洒落到烧杯外面,则配制溶液所溶解的氯化钠的质量不足7.5g,从而使溶质的质量减小,从而使溶质的质量分数减小。②正确;
③量取水时,仰视量取,则会导致量取的水的实际的体积大于42.5mL。则溶剂的质量增大,溶质的质量不变,则溶质的质量分数减小。③正确;
④溶液具有均一性和稳定性。装瓶时,有少量溶液洒出,溶质的质量分数不变。④错误。
故答案为:①②③。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案