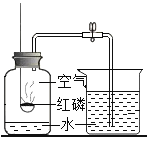
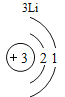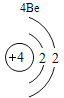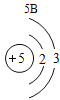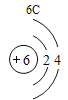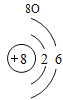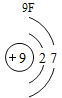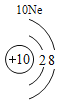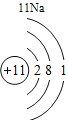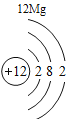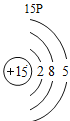题目内容
【题目】在宏观、微观和符号之间建立联系是化学学科的特点。
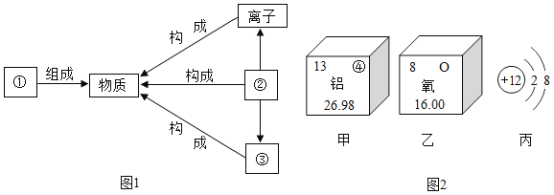
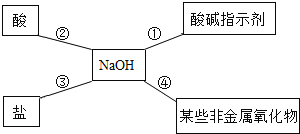
(1)将“分子”“原子”元素”填入如图1序号所对应的横线上:①_____;②_____。
(2)在铜、氯化钠、二氧化碳三种物质中,由分子构成的物质是_____。
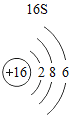
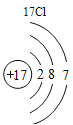
(3)根据原子结构的相关知识和图2的信息填空:甲图中④代表的元素符号是_____,乙图中所示元素的核电荷数是_____,丙图所示的粒子符号是_____。
【答案】元素 原子 二氧化碳 Al 8 Mg 2+
【解析】
(1)元素组成物质,故①填元素,分子、原子和离子是构成物质的基本微粒,原子能形成离子,能构成分子,故②是原子,③是分子,故填:元素;原子 ;
(2)铜是由铜原子构成的,氯化钠是由钠离子和氯离子构成的,二氧化碳是由二氧化碳分子构成的,故填:二氧化碳;
(3)甲图是铝元素,其元素符号为Al,乙图中氧元素的核电荷数为8,丙图所示离子是镁离子,带有两个单位的正电荷,故填:Al;8;Mg 2+。

 阅读快车系列答案
阅读快车系列答案【题目】元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容),回答有关问题:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
(1)请写出关于铍元素的一条信息_________________________________。
(2)表中3号和11号元素原子的最外层电子数相同,都易__________(填“得到”或“失去”)电子。钠元素和氟元素组成化合物的化学式为___________,构成该物质的微粒是___________(填“分子”原子”或“离子”)。
(3)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是____________(填字母序号)。
a.C和Ne
b.Be和Mg
C.Al和Si
d.S和O
(4)氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻,其主要原理是氢氟酸与玻璃的主要成分二氧化硅(SiO2)发生反应,生成四氟化硅气体(SiF4)和水,该反应的化学方程式为____________________________。
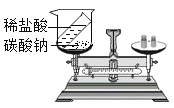
【题目】小明同学欲测定部分变质的氢氧化钠中碳酸钠的含量(含少量其他不溶性杂质),进行了如下实验:①取50g样品,加入足量水,待完全冷却后滤去不溶物,将得到的滤液平均分成五等份,倒入五个烧杯中;②向五个烧杯中分别加入一定质量14.6%的盐酸;③将充分反应后得到的溶液进行称量。实验过程中图像和所得数据如下,请你分析并进行有关计算:
烧杯Ⅰ | 烧杯Ⅱ | 烧杯Ⅲ | 烧杯Ⅳ | 烧杯Ⅴ | |
加入盐酸的质量(g) | 25 | 50 | 75 | 100 | 140 |
烧杯中溶液质量(g) | 55 | 80 | 104.78 | 129.34 | 168.9 |
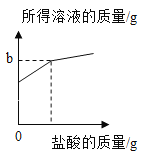
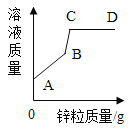
(1)通过分析上述图像及实验数据,烧杯中盐酸已经过量的有_______________________。
(2)样品中碳酸钠的质量分数是_____________?
(3)每份样品溶液的质量为______;坐标中b=_______________。
【题目】甲和乙的溶解度如下表,20 °C时,将甲、乙两种固体各18g,分别加人盛有50g水的烧杯中,充分溶解后,可观察到如图所示的现象,请回答下列问题:
温度/°C | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | 甲 | 35.7 | 36.0 | 36.5 | 37.3 | 38.4 |
乙 | 13.3 | 31.6 | 63.9 | 85.5 | 110 | |
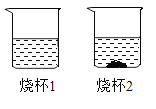
(1)40°C时甲物质的溶解度是_____g。
(2)烧杯1中溶液是_____(填“饱和”或“不饱和”)溶液。
(3)乙物质中含有少量的甲物质,通过_____方法可以提纯乙物质。
(4)将温度升高到80°C,两烧杯内溶液中溶质质量_____(填“相等”、“不相等’或“无法判断”)(不考虑水分蒸发)。
【题目】按要求填空:
(1)空气中含量最多的气体___________(填化学式),标出氯酸钾中氯元素的化合价____________。
(2)下表列出的是某品种西瓜每100g食用部分的主要营养成分数据。
营养成分 | 水分 | 蛋白质 | 脂肪 | 糖类 | X | 钙铁锌 |
质量 | 92.5g | 0.7g | 0.2g | 6.1g | 6.8mg | 17.1mg |
表中“X”是指人体所需六大基本营养素中的_________,西瓜中含有的__________元素可预防贫血。
(3)图中表示氧化汞分子受热分解发生反应的示意图:

根据上图你能获得的信息有:_______________(填符合题意的2条即可)。