题目内容
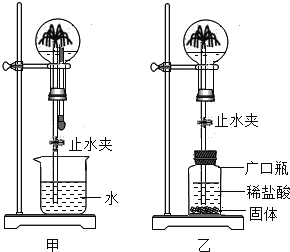
【题目】跑男团队在塞班岛海域快乐体验湛蓝的海水、怡人的海风。若要求利用热带丰富的太阳能淡化海水,用于解决海岛淡水资源缺乏全球性难题,海水淡化装置示意图如下图,请回答下列问题:

(1)该海水淡化装置从能源角度具有的优点是_________。海水中富含氯化钠等物质,从成本方面理解“海水淡化”是指__________。海水淡化发生了______变化(填“物理”或“化学”);
(2)在强烈的太阳光照射下,水变成水蒸气的过程中,不会发生变化的是_____(填序号);
A 分子质量 B 分子种类
C 分子间隔 D 分子运动速率
(3)利用上述海水淡化装置将一定量的海水暴晒一段时间后,在该装置内剩余海水中氯化钠的质量分数将会_____(填“变大”、“不变”或“变小”);
(4)实验室有一杯海水,将其变为纯净的水,你认为最可行的方法是_______。
【答案】节约能源等 除掉海水中氯化钠等可溶性杂质 物理 AB 变大 蒸馏
【解析】
物理变化是没有新物质生成的变化。
(1)该海水淡化装置从能源角度具有的优点是节约能源。海水中富含氯化钠等物质,从成本方面理解“海水淡化”是指除掉海水中氯化钠等可溶性杂质。海水淡化没有新物质生成,故发生了物理变化。
(2)水变成水蒸气的过程中,没有新物质生成,只是水分子间隔变大,故不会发生变化的是分子质量、分子种类,故选AB。
(3)利用上述海水淡化装置将一定量的海水暴晒一段时间后,水分蒸发,溶液中溶质质量不变,溶剂质量减少,则在该装置内剩余海水中氯化钠的质量分数将会变大。
(4)实验室有一杯海水,将其变为纯净的水,最可行的方法是蒸馏。

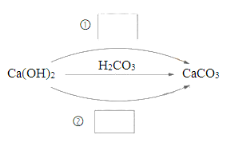
【题目】⑴化合物可以分为酸、碱、盐及氧化物。在下图中填写不同类别的物质__________(填化学式)实现Ca(OH)2一步转化为CaCO3。
⑵某Ca(OH)2 样品部分变质为CaCO3 (假设其成分均匀)。化学兴趣小组按以下步骤测定该样品中Ca(OH)2 的质量分数。
①配制盐酸:配制500g质量分数为6%的盐酸,需要质量分数为30%的盐酸_____g。
②实验测定:
称取10.0g样品置于烧杯中,加入足量稀盐酸充分反应,烧杯总质量与反应时间的关系如下表所示:
反应时间/min | 0 | t1 | t2 | t3 |
烧杯总质量/g | 280.0 | 278.9 | 277.8 | 277.8 |
完全反应后,生成的CO2气体的质量为___________g。
③数据处理:计算该样品中Ca(OH)2 的质量分数________(根据化学方程式的计算写出完整的计算步骤)。