题目内容
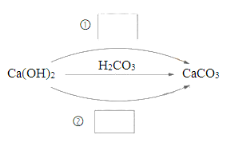
【题目】⑴化合物可以分为酸、碱、盐及氧化物。在下图中填写不同类别的物质__________(填化学式)实现Ca(OH)2一步转化为CaCO3。
⑵某Ca(OH)2 样品部分变质为CaCO3 (假设其成分均匀)。化学兴趣小组按以下步骤测定该样品中Ca(OH)2 的质量分数。
①配制盐酸:配制500g质量分数为6%的盐酸,需要质量分数为30%的盐酸_____g。
②实验测定:
称取10.0g样品置于烧杯中,加入足量稀盐酸充分反应,烧杯总质量与反应时间的关系如下表所示:
反应时间/min | 0 | t1 | t2 | t3 |
烧杯总质量/g | 280.0 | 278.9 | 277.8 | 277.8 |
完全反应后,生成的CO2气体的质量为___________g。
③数据处理:计算该样品中Ca(OH)2 的质量分数________(根据化学方程式的计算写出完整的计算步骤)。
【答案】 CO2(合理即可) Na2CO3(合理即可) 100 2.2 50%
【解析】本题考查了碱的化学性质,溶液的配制,根据化学方程式的计算。认真审题,弄清表格中数据与化学反应的关系是进行计算的基础。
(1)氢氧化钙与二氧化碳反应生成碳酸钙和水,氢氧化钙与碳酸钠反应生成碳酸钙和氢氧化钠,二氧化碳是氧化物,碳酸钠是盐,碳酸是酸,二氧化碳、碳酸钠、碳酸类别不相同,所以①可以是CO2或Na2CO3,②可以是Na2CO3或CO2;
(2)设:需要质量分数为30%的盐酸的质量为x。根据溶液在稀释前后溶质的质量不变,则有
500g×6%=x×30%, x=100g;
(3)根据表格中的数据可知,反应生成的二氧化碳的质量=280.0g-277.8g=2.2g;
设:碳酸钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
y 2.2g
![]() y=5g
y=5g
样品中Ca(OH)2 的质量分数=![]() ×100%=50%。
×100%=50%。
答:⑵①需要质量分数为30%的盐酸100g。
②完全反应后,生成的CO2气体的质量为2.2g。
③该样品中Ca(OH)2 的质量分数为50%。