题目内容
【题目】有一根部分氧化的镁条(只含氧化镁一种杂质),测得其中含镁元素的质量分数为80%,取此部分氧化的镁条3.0g与100g的稀硫酸恰好完全反应。则反应所使用的稀硫酸溶液中硫酸的质量分数为(已知:MgO+H2SO4=MgSO4+H2O)
A. 19.6% B. 4.9% C. 9.8% D. 无法确定
【答案】C
【解析】
Mg+H2SO4==MgSO4+H2↑,MgO+H2SO4=MgSO4+H2O,化学反应前后元素的种类、质量不变,反应后得到的MgSO4中Mg元素的质量等于反应前固体中镁元素的质量。反应前镁元素的质量为:3.0g×80%=2.4g,MgSO4的质量为2.4g÷![]() =12g,设 100g稀硫酸中所含硫酸的质量为x。
=12g,设 100g稀硫酸中所含硫酸的质量为x。
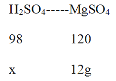
![]() =
=![]() ,解得x=9.8g
,解得x=9.8g
稀硫酸溶液中硫酸的质量分数为:![]() ×100%=9.8%,故选C。
×100%=9.8%,故选C。

练习册系列答案
相关题目