题目内容
【题目】食盐是一种重要的化工原料。请回答下列问题。
⑴请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
![]()
①操作Ⅰ的名称________________
②在过滤操作中,用到的玻璃仪器有:烧杯,玻璃棒和___________________.如果实验获得的精盐是潮湿的,则实验产率_______________(“偏大”或“偏小”或“无影响”)
⑵由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。 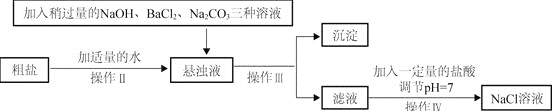
①加入盐酸调节滤液的pH=7目的是恰好除去过量的碳酸钠和____________,写出有气体产生的反应方程式______________________________________
②通过操作Ⅲ所得沉淀有:氢氧化镁,硫酸钡,碳酸钙和________________。如果稍过量的试剂加入的顺序依次为:Na2CO3, NaOH, BaCl2和盐酸,则最后得到的氯化钠溶液中一定含有杂质____.
操作Ⅳ的方法可以是:先在滤液中滴入酚酞溶液,再逐滴滴入盐酸直到滤液的pH=7的依据的现象是溶液由______色变为______色(或恰好无气体产生)。
【答案】 蒸发(或蒸发结晶) 漏斗 偏大 氢氧化钠(NaOH) Na2CO3 + 2HCl = 2NaCl + CO2↑+ H2O 碳酸钡(BaCO3) 氯化钡(BaCl2) 红 , 无 ;
【解析】(1) ①去除泥沙的步骤是:溶解、过滤、蒸发结晶;②该过程中用到的玻璃仪器主要有烧杯、玻璃棒和漏斗等,如果实验获得的精盐是潮湿的,则实验产率会偏大;(2)①
加入盐酸调节滤液的pH=7目的是恰好除去过量的碳酸钠和氢氧化钠(NaOH);碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3 + 2HCl = 2NaCl + CO2↑+ H2O;②通过操作Ⅲ所得沉淀有:氢氧化镁,硫酸钡,碳酸钙和碳酸钡(BaCO3),如果稍过量的试剂加入的顺序依次为:Na2CO3, NaOH, BaCl2和盐酸,则最后得到的氯化钠溶液中一定含有杂质是氯化钡(BaCl2),因为盐酸与氯化钡不反应;碳酸钠和氢氧化钠溶液显碱性,加入无色酚酞,溶液变红,盐酸和氯化钠遇到酚酞不变色,故操作Ⅳ的方法可以是:先在滤液中滴入酚酞溶液,再逐滴滴入盐酸直到滤液的pH=7的依据的现象是溶液由红色变为无色(或恰好无气体产生)。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
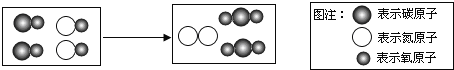
小博士期末闯关100分系列答案【题目】某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示溶液),他们对此产生了兴趣。
[提出问题]这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种。为了确定该药品,他们首先进行了理论分析:
(1)小明根据标签上的组成元素认为一定不可能是______。
(2)小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是_______。
为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验。
[设计实验]
实验操作 | 实验现象 |
取少量样品于试管中,慢慢滴加BaCl2溶液,静置一段时间,倾去上层清液,向沉淀中继续滴加稀盐酸 | 先出现白色沉淀,后产生大量气泡 |
[实验结论]
(3) 该瓶无色溶液是_______。生成白色沉淀过程的化学方程式是________。
[实验反思]
(4)小强认为上述设计实验还可简化,仍能达到目的。小强的实验操作是______。经查阅资料得知上述五种盐里碳酸钠、碳酸氢钠的溶液呈碱性,其余三种盐的溶液呈中性,请你再设计一种实验方法,确定该溶液究竟是哪种盐。简述实验操作和现象____________。