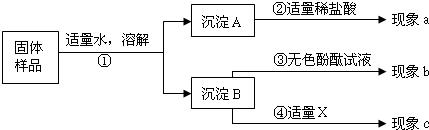
题目内容
 兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:
兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验.请你与他们一起完成以下探究活动:[对固体猜想]
猜想Ⅰ:全部是NaOH;
猜想Ⅱ:全部是Na2CO3;
猜想Ⅲ:
是NaOH和Na2CO3
是NaOH和Na2CO3
混合物.[查阅资料]
(1)氯化钙溶液呈中性.
(2)氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
[实验探究2]
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该样品配成溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡. | 有 白色沉淀 白色沉淀 生成. |
说明原固体中一定有 Na2CO3 Na2CO3 . |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. | 溶液变 红 红 色. |
说明原固体中一定有 NaOH NaOH . |
[反思与评价]
(1)氢氧化钠固体露置于空气中容易变质,请写出相关反应的化学方程式:
CO2+2NaOH═Na2CO3+H2O
CO2+2NaOH═Na2CO3+H2O
.(2)在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案
不可行
不可行
(填“可行”或“不可行”).理由氢氧化钙和碳酸钠反应会产生氢氧化钠
氢氧化钙和碳酸钠反应会产生氢氧化钠
.[理解与应用]
(1)氢氧化钠溶液容易变质,必须密封保存.实验室必须密封保存的药品还有很多,试另举一例:
浓盐酸(或浓硫酸等)
浓盐酸(或浓硫酸等)
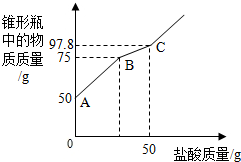
.(2)为检验其变质情况,进行了如下探究:取氢氧化钠样品10.0g于锥形瓶中,加入40.0g水,振荡形成溶液,向锥形瓶中逐滴滴加14.6%的稀盐酸,实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图所示.
求:10.0g样品中各成分的质量 (写出计算过程)
分析:【对固体猜想】Ⅲ:运用氢氧化钠和二氧化碳反应生成碳酸钠及猜想I、Ⅱ解答;
【实验探究2】运用碳酸钠和氯化钙反应生成碳酸钙沉淀和氢氧化钠显碱性设计实验方案;
【反思与评价】(1)运用氢氧化钠和二氧化碳反应生成碳酸钠和水书写反应的方程式;
(2)根据氢氧化钙和碳酸钠反应产生沉淀的同时还产生氢氧化钠对氢氧化钠的检验产生干扰进行分析;
【理解与应用】(1)根据常见需要密封保存的物质回答;
(2)向变质的氢氧化钠的溶液中滴加盐酸,盐酸先与氢氧化钠反应,生成氯化钠和水,而不能产生气体,因此,随盐酸的滴加瓶内质量不断增加,如图中的第一段曲线所示;当氢氧化钠完全反应后,继续滴加的盐酸开始与碳酸钠反应,即从图乙瓶内质量为75g时始,碳酸钠与盐酸反应生成氯化钠和水,同时放出气体二氧化碳,因此随盐酸的滴加瓶内物质质量增加情况如图乙中的第二段曲线;至碳酸钠完全反应后,滴加的盐酸不发生反应,瓶内质量增加情况如图乙中第三段曲线;根据与氢氧化钠阶段反应的化学方程式及消耗盐酸的质量,可计算出参加反应的氢氧化钠的质量,碳酸钠的质量为样品与氢氧化钠的质量差.
【实验探究2】运用碳酸钠和氯化钙反应生成碳酸钙沉淀和氢氧化钠显碱性设计实验方案;
【反思与评价】(1)运用氢氧化钠和二氧化碳反应生成碳酸钠和水书写反应的方程式;
(2)根据氢氧化钙和碳酸钠反应产生沉淀的同时还产生氢氧化钠对氢氧化钠的检验产生干扰进行分析;
【理解与应用】(1)根据常见需要密封保存的物质回答;
(2)向变质的氢氧化钠的溶液中滴加盐酸,盐酸先与氢氧化钠反应,生成氯化钠和水,而不能产生气体,因此,随盐酸的滴加瓶内质量不断增加,如图中的第一段曲线所示;当氢氧化钠完全反应后,继续滴加的盐酸开始与碳酸钠反应,即从图乙瓶内质量为75g时始,碳酸钠与盐酸反应生成氯化钠和水,同时放出气体二氧化碳,因此随盐酸的滴加瓶内物质质量增加情况如图乙中的第二段曲线;至碳酸钠完全反应后,滴加的盐酸不发生反应,瓶内质量增加情况如图乙中第三段曲线;根据与氢氧化钠阶段反应的化学方程式及消耗盐酸的质量,可计算出参加反应的氢氧化钠的质量,碳酸钠的质量为样品与氢氧化钠的质量差.
解答:解:【对固体猜想】Ⅲ:氢氧化钠可能是部分变质,含有NaOH和Na2CO3;故填:是NaOH和Na2CO3;
【实验探究2】根据实验结论氢氧化钠是部分变质,含有氢氧化钠和碳酸钠,二者都显碱性,因此先加入氯化钙检验碳酸钠并除去碳酸钠,碳酸钠和氯化钙反应生成碳酸钙沉淀;剩下的氢氧化钠显碱性能够使酚酞试液变成红色;故填:白色沉淀;Na2CO3;红;NaOH;
【反思与评价】(1)氢氧化钠和二氧化碳反应生成碳酸钠和水,反应的方程式为:CO2+2NaOH═Na2CO3+H2O;故填:CO2+2NaOH═Na2CO3+H2O;
(2)因为氢氧化钙和碳酸钠反应产生沉淀的同时还产生氢氧化钠对氢氧化钠的检验产生干扰,因此该方案不可行;故填:不可行;氢氧化钙和碳酸钠反应会产生氢氧化钠;
【理解与应用】(1)因为浓盐酸具有挥发性,浓硫酸具有吸水性,因此都需要密封保存;故填:浓盐酸(或浓硫酸等);
(2)由题意和坐标分析可知,曲线第一段物质增加的质量就是与氢氧化钠反应的盐酸的质量,即75g-50g=25g
设与盐酸反应的氢氧化钠的质量为x
HCl+NaOH=NaCl+H2O
36.5 40
25g×14.6% x
=
x=4g
因此碳酸钠的质量为:10g-4g=6g
答:10.0g样品中氢氧化钠的质量是4g,碳酸钠的质量是6g.
【实验探究2】根据实验结论氢氧化钠是部分变质,含有氢氧化钠和碳酸钠,二者都显碱性,因此先加入氯化钙检验碳酸钠并除去碳酸钠,碳酸钠和氯化钙反应生成碳酸钙沉淀;剩下的氢氧化钠显碱性能够使酚酞试液变成红色;故填:白色沉淀;Na2CO3;红;NaOH;
【反思与评价】(1)氢氧化钠和二氧化碳反应生成碳酸钠和水,反应的方程式为:CO2+2NaOH═Na2CO3+H2O;故填:CO2+2NaOH═Na2CO3+H2O;
(2)因为氢氧化钙和碳酸钠反应产生沉淀的同时还产生氢氧化钠对氢氧化钠的检验产生干扰,因此该方案不可行;故填:不可行;氢氧化钙和碳酸钠反应会产生氢氧化钠;
【理解与应用】(1)因为浓盐酸具有挥发性,浓硫酸具有吸水性,因此都需要密封保存;故填:浓盐酸(或浓硫酸等);
(2)由题意和坐标分析可知,曲线第一段物质增加的质量就是与氢氧化钠反应的盐酸的质量,即75g-50g=25g
设与盐酸反应的氢氧化钠的质量为x
HCl+NaOH=NaCl+H2O
36.5 40
25g×14.6% x
| 36.5 |
| 25g×14.6% |
| 40 |
| x |
因此碳酸钠的质量为:10g-4g=6g
答:10.0g样品中氢氧化钠的质量是4g,碳酸钠的质量是6g.
点评:本题考查了氢氧化钠变质情况的探究,要注意氢氧化钠和变质的产物碳酸钠均显碱性,因此要验证氢氧化钠的存在,需要排除碳酸钠碱性的干扰;在计算氢氧化钠部分变质中物质的含量时,要依据坐标结合题意分清各段表示的意义.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目