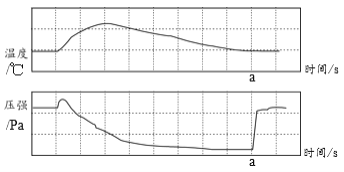
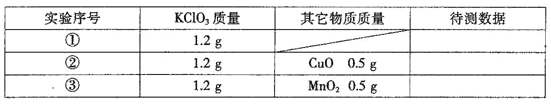
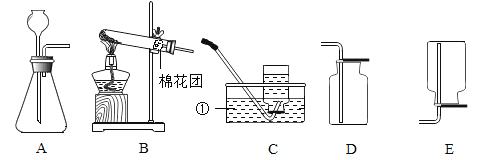
题目内容
【题目】在反应3CO+Fe2O3![]() 2Fe+3CO2中,铁元素的化合价由+3变为0,碳元素的化合价由+2变为+4,这类在化学反应前后有化合价变化的反应属于氧化还原反应。据此判断,下列反应不属于氧化还原反应的是( )
2Fe+3CO2中,铁元素的化合价由+3变为0,碳元素的化合价由+2变为+4,这类在化学反应前后有化合价变化的反应属于氧化还原反应。据此判断,下列反应不属于氧化还原反应的是( )
A. 2H2+O2![]() 2H2O B. Fe+CuSO4===FeSO4+Cu
2H2O B. Fe+CuSO4===FeSO4+Cu
C. 2H2O2![]() 2H2O+O2↑ D. Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
2H2O+O2↑ D. Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
【答案】D
【解析】
据题给信息,发生氧化还原反应时,一定有元素化合价的改变。A. 2H2+O2![]() 2H2O,氢元素的化合价由0变为+1,氧元素的化合价由0变为-2,属于氧化还原反应,此选项不符合题意;B. Fe+CuSO4===FeSO4+Cu,铁元素的化合价由0变为+2,铜元素的化合价由+2变为0,属于氧化还原反应,此选项不符合题意;C. 2H2O2
2H2O,氢元素的化合价由0变为+1,氧元素的化合价由0变为-2,属于氧化还原反应,此选项不符合题意;B. Fe+CuSO4===FeSO4+Cu,铁元素的化合价由0变为+2,铜元素的化合价由+2变为0,属于氧化还原反应,此选项不符合题意;C. 2H2O2![]() 2H2O+O2↑,氧元素的化合价部分由-1变为-2,部分由-1变为0,属于氧化还原反应,此选项不符合题意;D. Fe2O3+3H2SO4===Fe2(SO4)3+3H2O,各种元素的化合价均不变,不属于氧化还原反应,此选项符合题意。故选D。
2H2O+O2↑,氧元素的化合价部分由-1变为-2,部分由-1变为0,属于氧化还原反应,此选项不符合题意;D. Fe2O3+3H2SO4===Fe2(SO4)3+3H2O,各种元素的化合价均不变,不属于氧化还原反应,此选项符合题意。故选D。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
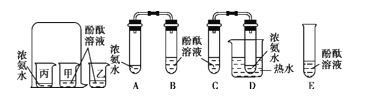
三点一测快乐周计划系列答案【题目】在研究酸和碱的化学性质时,某小组想证明稀硫酸和氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应。试与他们一起完成实验方案的设计、实施和评价,并得出有关结论。
(1)探究稀硫酸和氢氧化钠溶液的反应。
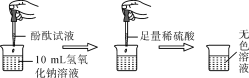
当在NaOH溶液中滴入几滴酚酞试液后,溶液由无色变为______色。根据上述实验中颜色变化,可确定稀硫酸和氢氧化钠溶液发生了化学反应,反应的化学方程式为________________。
(2)探究上述稀硫酸和氢氧化钠溶液反应后烧杯中的硫酸是否过量。
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量。同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀硫酸过量 |
方案二 | 取样,滴入几滴紫色石蕊试液 | 溶液变红 | 稀硫酸过量 |
上述设计的实验方案中,正确的是_________(填“方案一”或“方案二”);另外一个实验方案错误的原因是__________________________。
【题目】某些植物的花汁可作酸碱指示剂.取三种花汁用稀酸溶液或稀碱溶液检验,颜色如表:
花种类 | 花汁在酒精(中性)中颜色 | 花汁在稀酸中颜色 | 花汁在稀碱中颜色 |
玫瑰花 | 粉红 | 粉红 | 绿 |
万寿菊花 | 黄 | 黄 | 黄 |
大红花 | 粉红 | 橙 | 绿 |
试回答下列问题:
![]() 为试验生活中的食盐水、肥皂水、汽水、石灰水四种物质的酸碱性,我选择________花汁,不选用其他花汁的原因是________
为试验生活中的食盐水、肥皂水、汽水、石灰水四种物质的酸碱性,我选择________花汁,不选用其他花汁的原因是________
![]() 取所选花汁少许分别滴入上述四种物质,请将所显颜色填入表中:
取所选花汁少许分别滴入上述四种物质,请将所显颜色填入表中:
试验物质 | 食盐水 | 肥皂水 | 汽水 | 石灰水 |
所显颜色 | _______ | _______ | _______ | _______ |