题目内容
【题目】某科学兴趣小组在综合实践活动中,从石灰厂带来一块石灰石样品,技术员告诉他们此样品中含有的杂质是二氧化硅,二氧化硅难溶于水,不能与盐酸反应。为了测定该石灰石的纯度,兴趣小组同学取用10g这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸120g分6次加入,充分反应后,经过滤、干燥等操作后称量,得到如下数据:
实验次数 | 1 | 2 | 3 | 4 | 5 | 6 |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 | 20 |
剩余固体的质量/g | 8.0 | m | 4.0 | 2.0 | 1.2 | 1.2 |
求:(1)表中m的值为______g。
(2)该石灰石样品的纯度______
(3)所用稀盐酸的溶质质量分数______
【答案】6.0 88% 7.3%
【解析】
解:(1)第一次加入20g稀盐酸,固体质量减少了10g-8g=2g,第三次加入20g稀盐酸,固体质量变为4.0g,说明第一次实验中,固体中含有碳酸钙,从第一次实验到第三次实验,共加入40g稀盐酸,固体质量减少了8.0g-4.0g=4.0g,所以第二次加入加入20g稀盐酸,固体质量也减少了2.0g,即m=8.0g-2.0g=6.0g。
(2)由表中数据可知,剩余固体的质量为1.2g以后即使再加入稀盐酸固体质量也不再减少,所以1.2g为杂质二氧化硅的质量,该石灰石样品中碳酸钙的质量为:10g-1.2g=8.8g,该石灰石样品的纯度为:![]() ×100%= 88%
×100%= 88%
(3)设所用稀盐酸的溶质质量为x。

![]() =
=![]() ,解得x=1.46g
,解得x=1.46g
所用稀盐酸的溶质质量分数为:![]() ×100%=7.3%
×100%=7.3%

 阳光同学一线名师全优好卷系列答案
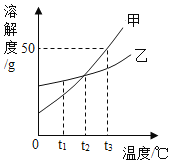
阳光同学一线名师全优好卷系列答案【题目】“如图”表示元素的化合价与物质类别关系。若它表示氮元素的部分关系图。则:
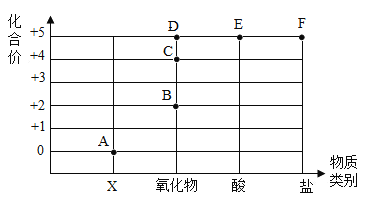
(1) A点对应的物质类别是______;
(2)写出B点、E点表示物质的化学式各一个为 _________ 、_______ 。
(3)某化合物的化学式为KNO3,它代表的点是______(填字母);
(4)根据物质的_____________,可以把物质分成混合物和纯净物。
(5)完成鉴别氯化钾和氯化铵两种固体化肥的实验报告。
实验步骤 | 实验现象 | 实验结论 |
_________ | _________ | _________ |
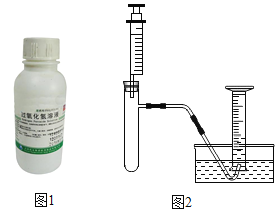
【题目】实验探究:小林同学在体育课上腿部擦伤,医务室的大夫在她伤口上涂了医用过氧化氢溶液,小林看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?
I.小林准备用如图2所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气,记录2分钟收集的气体体积。
(1)请写出过氧化氢分解的化学方程式:,_____
(2)若要检验生成的气体是否为氧气,可将导气管从水中取出,_____,说明生成的气体是氧气。
Ⅱ.小林查阅了相关资料,并进行了探究实验
(查阅资料)(1).过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
(2).温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)
猜想1:过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(进行实验)
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 分两次进行实验,均注入5mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5mL | 猜想_____不成立 |
② | 分两次进行实验 第一次将装有一小粒过氧化氢酶的试管浸在37℃的温水中,注入5mL过氧化氢溶液 第二次_____ | 第一次,量筒中2分钟收集到的气体体积为56mL 第二次,量筒中2分钟收集到的气体体积为5mL | 猜想_____成立 |
(实验反思)
小林反思了实验过程,认为人体中过氧化氢酶是在体温条件下发挥作用的,实验得出的结论可能存在不足。因此又补充进行了几组实验,数据记录如下表所示。
加入过氧化氢酶 | 不加过氧化氢酶 | |||||
反应温度/℃ | 25 | 37 | 42 | 25 | 37 | 42 |
收集到气体体积/mL | 39 | 56 | 60 | 5 | 5 | 5 |
通过这些数据,你能得出的新结论是_____。
要证明某物质是催化剂,还需要证明的是_____。