题目内容
【题目】下表是生活饮用水国家标准的部分内容. 生活饮用水水质常规检验项目及限值(部分)
项目 | 限值 |
色度 | 不超过15度,并不得呈现其他异色 |
浑浊度 | 不超过1度,特殊情况下不超过5度 |
pH | 6.5﹣8.5 |
总硬度(以CaCO3计) | 450mg/L |
铝 | 0.2mg/L |
铁 | 0.3mg/L |
硫酸盐 | 250mg/L |
(1)上表中“铝”指的是(选填“单质”、“元素”或“原子”);
(2)生活中硬水软化的方法是;
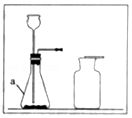
(3)实验室用上述水样通电分解,产生氢气和氧气的体积比约为;
(4)消毒剂漂白粉的有效成分是Ca(ClO)2 , 其中氯元素的化合价是;
(5)1L合格的生活饮用水中,均以CaCO3计算硬度,则钙元素的含量不超过mg/L.
【答案】
(1)元素
(2)煮沸
(3)2:1
(4)+1价
(5)180
【解析】解:(1)食品、药品、营养品、矿泉水等物质中的“铁、铝”等不是以单质、分子、原子、离子等形式存在,这里所指的“铝”是强调存在的元素,与具体形态无关.故填:元素;(2)加热煮沸能减少水中钙、镁离子的化合物的含量.所以,生活中常用的硬水软化的方法是煮沸;故填:煮沸;(3)实验室用中将水通电分解,产生氢气和氧气的体积比约为2:1;故填:2:1;(4)在Ca(ClO)2中,钙为+2价,氧为﹣2价,设氯元素的化合价为x,则(+2)+2x+(﹣2)×2=0,x=1;故填:+1价;(5)由题目信息可知,1L合格的生活饮用水中,CaCO3的质量不能超过450mg,则钙元素的含量应不超过:450mg× ![]() =180mg;故填:180;
=180mg;故填:180;
【考点精析】解答此题的关键在于理解电解水实验的相关知识,掌握电解水的实验:A.装置―――水电解器B.电源种类---直流电C.加入硫酸或氢氧化钠的目的----增强水的导电性D.化学反应:2H2O=== 2H2↑+ O2↑,以及对硬水与软水的理解,了解硬水和软水的鉴别方法:用肥皂水,有浮渣产生或泡沫较少的是硬水,泡沫较多的是软水.

 小夫子全能检测系列答案
小夫子全能检测系列答案