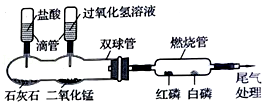
��Ŀ����
����Ŀ��ʵ�������������ȡ������ 
��1��д�����Ϊa������������
��2����Ӧ�ķ���װ������
��3����Ӧ�Ļ�ѧ����ʽ����
��4���÷�����ƽ��ȡ3.50g����غ�1.00g�������̻�ϼ��ȣ��Ƶ÷�Ӧ��������������Ϊ3.54g�� �ٶ��������ڹ��������е����������仯��������
��ͨ����֪�����г������Ȼ���������x���ı���ʽΪ��
��ʣ���������������ص�����Ϊg��
���𰸡�
��1���ƾ���
��2��A
��3��2KClO3 ![]() 2KCl+3O2��
2KCl+3O2��
��4������![]() ��1.05
��1.05
���������⣺��1��a�����Ǿƾ��ƣ�����ƾ��ƣ���2�����������ȡ�������ڹ�������ͣ�����ѡ��װ��A����ȡ�����A����3���ڶ��������������������£���������طֽ�Ϊ�Ȼ��غ����������2KClO3 ![]() 2KCl+3O2���� ��4������Ϊ����ع������ȷֽ�Ϊ�Ȼ��غ�������������������٣�������������Ϊ�������������ڷ�Ӧ�в��䣬���Զ��������ڹ��������е����������仯����������������������غ㶨�ɿ�֪����������������Ϊ��3.50g+1.00g��3.54g=0.96g���������Ȼ��ص�����Ϊx���μӷ�Ӧ������ص�����Ϊy����
2KCl+3O2���� ��4������Ϊ����ع������ȷֽ�Ϊ�Ȼ��غ�������������������٣�������������Ϊ�������������ڷ�Ӧ�в��䣬���Զ��������ڹ��������е����������仯����������������������غ㶨�ɿ�֪����������������Ϊ��3.50g+1.00g��3.54g=0.96g���������Ȼ��ص�����Ϊx���μӷ�Ӧ������ص�����Ϊy����
2KClO3 | 2KCl+ | 3O2�� |
245 | 149 | 96 |
y | x | 0.96g |
![]()
��� ![]() ����
���� ![]()
y=2.45g
ʣ���������������ص�����Ϊ3.50g��2.45g=1.05g
���1.05��
�����㾫����������Ĺؼ�����������������ȡװ�õ����֪ʶ�����շ���װ�ã��̹̼����͡���Һ�������ͣ��Լ����������ռ����������⣬�˽��ռ�װ�ã��������ʵ��ܶȡ��ܽ��ԣ���ˮ���ռ�ʱ�������ݾ�������ð��ʱ���ռ����տ�ʼ�ų������Թ��еĿ����������ſ������ռ�����ʱ�������쵽����ƿ�ײ���

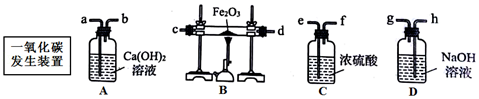
����Ŀ������a��b��c���ֽ�����a��b�ֱ���ϡ���ᣬc����������Һ���õ����������ʾ��
a | b | |
��ϡ�������� | ��Ӧ | �ܽⲢ�ų����� |
��c����������Һ���� | ����������c | ����������c |
���ݱ���������ʵ�������ж������ֽ��������ǿ������˳����ȷ���ǣ� ��
A��c��b��a B��a��b��c C��b��a��c D��a��c��b
����Ŀ���±�����������ˮ���ұ��IJ������ݣ� ��������ˮˮ�ʳ��������Ŀ����ֵ�����֣�
��Ŀ | ��ֵ |
ɫ�� | ������15�ȣ������ó���������ɫ |
���Ƕ� | ������1�ȣ���������²�����5�� |
pH | 6.5��8.5 |
��Ӳ�ȣ���CaCO3�ƣ� | 450mg/L |
�� | 0.2mg/L |
�� | 0.3mg/L |
������ | 250mg/L |
��1���ϱ��С�����ָ������ѡ����ʡ�����Ԫ�ء���ԭ�ӡ�����
��2��������Ӳˮ�����ķ�������
��3��ʵ����������ˮ��ͨ��ֽ⣬���������������������ԼΪ��
��4��������Ư�۵���Ч�ɷ���Ca��ClO��2 �� ������Ԫ�صĻ��ϼ�����
��5��1L�ϸ����������ˮ�У�����CaCO3����Ӳ�ȣ����Ԫ�صĺ���������mg/L��
����Ŀ��һЩʳ���pH��Χ�����
ʳ�� | ������ | ţ�� | ƻ��֭ | ������ |
pH | 4.0��4.4 | 6.3��6.6 | 2.9��3.3 | 7.6��8.0 |
����������ǿ����(����)
A. ţ�� B. ������ C. ������ D. ƻ��֭