题目内容
(2007?宁德)(1)金属镁是一种活泼的金属,可与热水反应生成氢气和氢氧化镁[Mg(OH)2].写出该反应的化学方程式:
(2)某同学将镁条放在热水中煮沸,趁热取出部分溶液,滴加酚酞溶液变红色,放置空气中一段时间后,发现溶液红色褪去.这是什么原因?甲、乙、丙三位同学根据他们所学的化学知识,分别对这种现象的形成原因,作如下猜想:
甲:可能是酚酞变质造成的;
乙:溶液可能吸收了空气中的CO2;
丙:氢氧化镁的溶解度随温度的降低而变小.
①乙、丙同学根据实验现象认为甲同学的猜想是不正确的,他们的理由是:
②三位同学讨论认为要验证乙同学的猜想需作如下实验,你知道其实验目的吗?
③若丙同学的猜想有其合理性,你能设计实验证明吗?
④除了以上的猜测,我还对这种现象的形成原因,作如下猜想:
Mg+2H2O
Mg(OH)2+H2↑
| ||
Mg+2H2O
Mg(OH)2+H2↑
.
| ||
(2)某同学将镁条放在热水中煮沸,趁热取出部分溶液,滴加酚酞溶液变红色,放置空气中一段时间后,发现溶液红色褪去.这是什么原因?甲、乙、丙三位同学根据他们所学的化学知识,分别对这种现象的形成原因,作如下猜想:
甲:可能是酚酞变质造成的;
乙:溶液可能吸收了空气中的CO2;
丙:氢氧化镁的溶解度随温度的降低而变小.
①乙、丙同学根据实验现象认为甲同学的猜想是不正确的,他们的理由是:
若酚酞变质,刚开始溶液就不会变红色
若酚酞变质,刚开始溶液就不会变红色
.②三位同学讨论认为要验证乙同学的猜想需作如下实验,你知道其实验目的吗?
| 实验方法 | 实验目的 |
| 将上述红色溶液在充满CO2的容器中恒温放置一段时间 | 进行对比实验,证明溶液褪色是否因吸收CO2引起 进行对比实验,证明溶液褪色是否因吸收CO2引起 |
| 将上述红色溶液在隔绝空气条件下恒温放置一段时间 |
| 实验方法 | 可能观察到的现象和结论 |
将原褪色的溶 液升高温度(加热) 将原褪色的溶 液升高温度(加热) |
若溶液恢复成红色,则说明氢氧化镁溶解度随温度的降低而变小是造成溶液褪色的原因 若溶液恢复成红色,则说明氢氧化镁溶解度随温度的降低而变小是造成溶液褪色的原因 |
溶液褪色可能因为溶液中的酚酞与空气中的氧气反应
溶液褪色可能因为溶液中的酚酞与空气中的氧气反应
.分析:(1)利用反应物生成物及反条件结合化学方程式的书写解决即可.
(2)①酚酞变质时刚开始溶液不会变红.
②是进行对比试验证明二氧化碳的作用.
③氢氧化镁的溶解度随温度的降低而变小所以升温后看红色是否恢复,进而作出判断.
④从酚酞自身会与空气中的氧气反应分析猜想.
(2)①酚酞变质时刚开始溶液不会变红.
②是进行对比试验证明二氧化碳的作用.
③氢氧化镁的溶解度随温度的降低而变小所以升温后看红色是否恢复,进而作出判断.
④从酚酞自身会与空气中的氧气反应分析猜想.
解答:答:(1)依据反应物是水与镁生成物是氢氧化镁和氢气,条件是加热,结合化学方程式的书写要求完成即可.
(2)①甲同学的猜想也有明显错误,因为一开始加入时酚酞已经变红了,而酚酞遇碱性溶液变红是酚酞的特性,一开始变红说明酚酞未变质.
②是进行对比试验证明二氧化碳的作用,通过溶液通入二氧化碳的现象可对比出二氧化碳的作用.
③如果氢氧化镁的溶解度随温度的降低而变小所以升温后氢氧化镁的溶解度升高红色就会重新出现,进而作出红色消失原因的判断.
④酚酞自身也可能与空气中的成分特别是氧气反应导致红色褪去.
故答案为:(1)Mg+2H2O
Mg(OH)2+H2↑
(2)①若酚酞变质,刚开始溶液就不会变红色;
②进行对比实验,证明溶液褪色是否因吸收CO2引起;
③
④溶液褪色可能因为溶液中的酚酞与空气中的氧气反应.
(2)①甲同学的猜想也有明显错误,因为一开始加入时酚酞已经变红了,而酚酞遇碱性溶液变红是酚酞的特性,一开始变红说明酚酞未变质.
②是进行对比试验证明二氧化碳的作用,通过溶液通入二氧化碳的现象可对比出二氧化碳的作用.
③如果氢氧化镁的溶解度随温度的降低而变小所以升温后氢氧化镁的溶解度升高红色就会重新出现,进而作出红色消失原因的判断.
④酚酞自身也可能与空气中的成分特别是氧气反应导致红色褪去.
故答案为:(1)Mg+2H2O
| ||
(2)①若酚酞变质,刚开始溶液就不会变红色;
②进行对比实验,证明溶液褪色是否因吸收CO2引起;
③
| 实验方法 | 可能观察到的现象和结论 |
| 将原褪色的溶 液升高温度(加热) |
若溶液恢复成红色,则说明氢氧化镁溶解度随温度的降低而变小是造成溶液褪色的原因 |
点评:本题是已设计的实验方案进行评价,以及自己设计实验方案的题目,要注意考虑所涉及物质的化学性质,据它们的化学性质来设计方案,这是我们解题的大方向.

练习册系列答案
相关题目
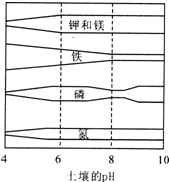 (2007?宁德)植物的生长需要一些营养元素,右图表示了土壤的p H和植物吸收这些营养元素的关系.图中栅栏越宽,表示营养元素的吸收率越高.下列说法中不正确的是( )
(2007?宁德)植物的生长需要一些营养元素,右图表示了土壤的p H和植物吸收这些营养元素的关系.图中栅栏越宽,表示营养元素的吸收率越高.下列说法中不正确的是( ) 蔬菜 B、
蔬菜 B、 鸡蛋
鸡蛋  植物油 D、
植物油 D、