题目内容
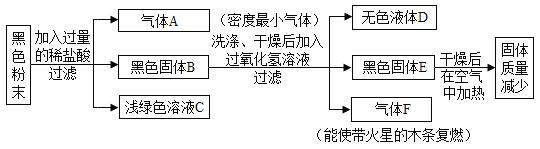
【题目】碱性锌锰干电池(内部填充物为锌粉、碳粉、KOH、MnO2等)是目前应用广泛的家用电池,在使用过程中会转化为氢氧化氧锰(MnOOH)和ZnO。化学兴趣小组取出旧碱性锌锰干电池中的固体填充物,在常温下做如图过程处理:
[资料在线]
(1)MnO2不溶于水,且常温下不与稀盐酸反应。
(2)氢氧化氧锰与盐酸反应的化学方程式为:2MnOOH+2HCl=MnCl2+MnO2+2H2O。
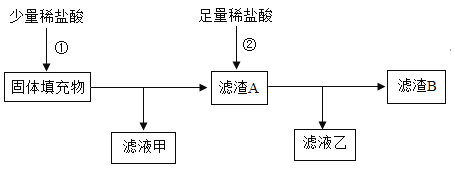
请回答:
(1)步骤①发生了中和反应,溶液的pH下降至9并生成一种盐,该盐的化学式为____。
(2)步骤②中稀盐酸与三种物质反应,其中可产生无色无味的可燃性气体的反应化学方程式为____;其中与氧化锌的反应,属于_____(填基本反应类型)。
(3)滤渣B中除含氧元素以外,一定还含有_____元素。
(4)若MnO2全部转化为MnOOH时,则电池电量耗尽。借助仪器测得滤液乙中的锰元素质量占旧电池中锰元素总质量的22%,该旧电池电量理论上已使用____%。
【答案】KCl Zn+2HCl=ZnCl2+H2↑ 复分解反应 C、Mn 44%
【解析】
(1)步骤1发生酸碱中和反应,为电池中的碱KOH和稀盐酸反应,生成盐为KCl。
(2)生成无色无味可燃性气体,推测为氢气,反应方程式: Zn+2HCl=ZnCl2+H2↑。盐酸与氧化锌的反应生成氯化锌和水,是两种化合物相互交换成分生成另外两种化合物,属于复分解反应。
(3)滤渣B中有不参与反应的碳粉和反应后剩余MnO2,因此,滤渣B中除含氧元素以外,一定还含有C、Mn元素
(4)滤液乙中的锰离子来自于氢氧化氧锰(MnOOH)与盐酸反应,测得滤液乙中的锰元素质量占旧电池中锰元素总质量的22%,根据方程式2MnOOH+2HCl=MnCl2+MnO2+2H2O,计算可知氢氧化氧锰(MnOOH)的锰元素质量是滤液中锰离子质量的2倍,占44%。所以该旧电池电量理论上已使用44%。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案