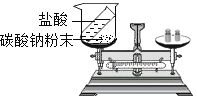
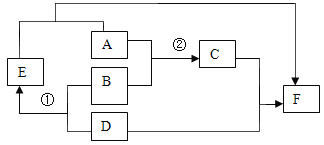
题目内容
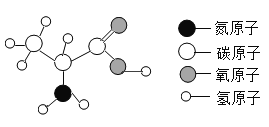
【题目】已知所含元素化合价发生变化的反应是氧化还原反应,其中被还原的元素化合价降低,被氧化的元素化合价升高。海洋中有丰富的资源,如下图所示利用海水可获得许多化工产品。下列有关说法正确的是( )
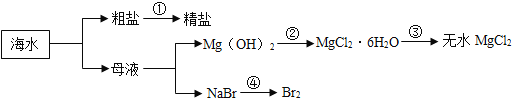
A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的试剂顺序为:Na2CO3溶液、NaOH溶液、BaCl2溶液,过滤后加盐酸
B.第②步中加入的试剂为CaCl2溶液
C.第③步中发生分解反应
D.在第④步中溴元素被氧化
【答案】CD
【解析】
A、除去粗盐中的SO42-、Ca2+、Mg2+等杂质,可以先除硫酸根离子,需要过量BaCl2溶液,再除镁离子,需要过量NaOH溶液,最后除钙离子,加入过量Na2CO3溶液,最后加入过量稀盐酸除去过量的碳酸钠和氢氧化钠;但碳酸钠一定要在氯化钡之后加入,因为碳酸钠既可以除去钙离子,又可以去除过量的氯化钡,故A错误;
B、氢氧化镁是沉淀,氯化钙不能与氢氧化镁反应,由②中物质的组成可知,要与氢氧化镁反应应选择盐酸,故B错误;
C、由③的转化可知,结晶水合物失去结晶水并生成氯化镁,是一种物质反应生成两种物质,则属于分解反应,故C正确;
D、由④可知NaBr→Br2,NaBr中溴元素的化合价为-1价,单质中溴元素的化合价为0,则在反应中溴元素的化合价升高,由信息可知溴元素被氧化,故D正确;
故选:CD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】小雨发现一种神奇的蜡烛,点燃后发现怎么也“吹不灭”,于是对这种蜡烛产生了浓厚的兴趣,下面请你和小雨一起进行探究。

[查阅资料]
普通蜡烛由石蜡和烛芯制成,吹不灭的蜡烛在普通蜡烛的烛芯外包裹了一层打火石。打火石是在某种金属中掺入少量稀土元素制成的合金,它的着火点只有150°C蜡烛燃烧时包裹在石蜡内的打火石并不燃烧,当吹“灭”蜡烛时,未冷却的金属接触到氧气就发生燃烧,从而使蜡烛复燃。
[问题与思考]
(1)蜡烛燃烧时,包裹在石蜡内的打火石并不燃烧,原因是:_____,如果将这种蜡烛熄灭,你应采用的方法是_____。
(2)蜡烛芯外包裹的打火石中的金属是什么?
[实验探究]
吹不灭的蜡烛芯外的打火石含的金属可能是镁、铝、铁或铜中的一种,为确定该金属的成分,他们决定继续探究。(不考虑打火石中稀土元素对探究金属性质的影响)
实验序号 | 实验操作 | 现象 | 结论 |
1 | 取该打火石,用砂纸打磨后观察 | 打火石呈_____色 | 打火石中的金属一定不是铜 |
2 | 取少量打磨后的打火石于试管中,加入稀盐酸 | 有气泡产生,溶液无色 | 打火石中的金属一定不是_____。 |
3 | 将少量打磨后打火石加入到硫酸铜溶液中 | 打火石表面有红色物质析出 | 打火石中的金属一定是镁 |
[讨论交流]
(1)实验3中涉及的化学方程式为_____。
(2)你认为实验3的方案是否合理_____(填“是”或“否”),如合理请说明理由,如不合理请设计一个方案进一步确认该金属是镁:_____。