题目内容
现有铜、锌混合物5克,与48.78克稀硫酸恰好完全反应,获得氢气0.04克,求:
(1)原混合物中锌的质量分数?(保留一位小数)
(2)反应后所得溶液中溶质的质量分数?(保留两位小数)
(1)原混合物中锌的质量分数?(保留一位小数)
(2)反应后所得溶液中溶质的质量分数?(保留两位小数)
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)由于铜与酸不反应,只有锌与酸反应生成氢气,根据氢气的质量算出锌的质量;
(2)根据氢气的质量算出硫酸锌的质量,用硫酸锌的质量除以反应后溶液的质量乘以百分之百即可.
(2)根据氢气的质量算出硫酸锌的质量,用硫酸锌的质量除以反应后溶液的质量乘以百分之百即可.
解答:解:由于混合物种只有锌和硫酸反应能够得到氢气,所以可以根据氢气的质量求算出锌的质量.
设要生成0.04g氢气需要参加反应的锌的质量为x,同时生成硫酸锌的质量为y.
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.04g
=
解得x=1.3g,
=
解得y=3.22g.
(1)原混合物中锌的质量分数为:
×100%=25.2%
(2)反应后溶液的质量=1.3g+48.78g-0.04g=50.04g,所以所得溶液溶质的质量分数为:
×100%=6.44%
答案:
(1)原混合物中锌的质量分数为25.2%
(2)所得溶液溶质的质量分数为6.44%
设要生成0.04g氢气需要参加反应的锌的质量为x,同时生成硫酸锌的质量为y.
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.04g
| 65 |
| 2 |
| x |
| 0.04g |
解得x=1.3g,
| 161 |
| 2 |
| y |
| 0.04g |
解得y=3.22g.
(1)原混合物中锌的质量分数为:
| 1.3g |
| 5g |
(2)反应后溶液的质量=1.3g+48.78g-0.04g=50.04g,所以所得溶液溶质的质量分数为:
| 3.22g |
| 50.04g |
答案:
(1)原混合物中锌的质量分数为25.2%
(2)所得溶液溶质的质量分数为6.44%
点评:解答本题关键是要知道铜与酸不反应,在计算反应后所得溶液质量时别忘了减去氢气质量.

练习册系列答案
相关题目
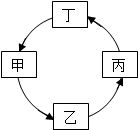 如图表所列各组物质中,物质之间按箭头方向通过一步反应就能实现如图所示转化的是 ( )
如图表所列各组物质中,物质之间按箭头方向通过一步反应就能实现如图所示转化的是 ( )| 甲 | 乙 | 丙 | 丁 | |
| A | CO2 | CaCO3 | H2O | O2 |
| B | NaOH | NaCl | CO2 | Na2CO3 |
| C | H2O2 | H2O | O2 | MgO |
| D | CaO | Ca(OH)2 | H2O | CaCl2 |
| A、A | B、B | C、C | D、D |
一杯溶液里各部分的性质是( )
| A、不相同的 | B、上面跟下面不同 |
| C、相同的 | D、无法比较 |
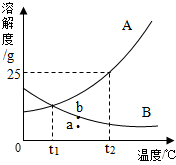 请根据如图中A、B两种固体物质的溶解度曲线,回答下列问题.
请根据如图中A、B两种固体物质的溶解度曲线,回答下列问题.