题目内容
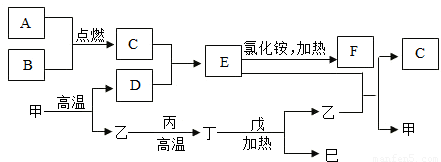
(2008?大庆)某校化学研究性学习小组探究气体制取的实验原理与方法.(1)甲同学将课本的基础知识进行整理如图,请你帮助他完成相关内容.

| 制取气体 | 所需要品 | 装置连接顺序 | 反应的化学方程式 |
| 氧气 | 氯酸钾和二氧化锰 | ||
| 二氧化碳(干燥) | 大理石和稀盐酸 |
K2时,利用I、Ⅱ装置可直接进行的实验是______(填序号).
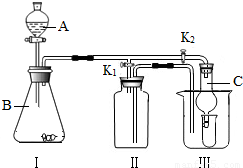
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丙同学认为在不改变I、Ⅱ、Ⅲ装置的仪器及
位置的前提下,该装置可用于过氧化钠(Na2O2)与水反应制取氧气,另一产物为氢氧化钠,则该反应的化学方程式为:______;她的改进措施是______.
(4)丁同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时C中盛放的物质是______,可以观察到的现象是______.
(5)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰.正确操作的先后顺序是______(填写选项序号).
a.烘干b.溶解c.过滤d.洗涤
②用所得氯化钾晶体配制50g质量分数为5%的氯化钾溶液,需要氯化钾的质量为______.
③过滤、蒸发时都需用到的仪器是______(填序号).
A.酒精灯B.烧杯C.玻璃棒D.漏斗E.量筒
(6)小明用6.5g可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成0.2g氢气,则此锌粉中一定含有的金属杂质是______.
【答案】分析:(1)用氯酸钾和二氧化锰反应制取氧气需要加热反应,据此选择发生装置;又因氧气的密度大于空气的密度,并且不易溶于水,选择收集装置;然后写出化学反应式即可;大理石与稀盐酸反应制取二氧化碳,是固液在常温下反应,据此选择发生装置;根据二氧化碳密度大于空气的密度,易溶于水,选择收集装置;又因为要收集干燥的二氧化碳,所以要连接装置E;
(2)观察图示可知是固液在常温下的反应,并且收集气体的密度应小于空气的密度,然后选择即可;
(3)根据反应物是过氧化钠(Na2O2)与水,生成物是氧气和氢氧化钠写出化学反应式即可;因氧气不易溶于水,可用排水法收集.
(4)检验水一般用无水硫酸铜,无水硫酸铜遇水变蓝;
(5)从KCl和MnO2混合物中回收二氧化锰,根据MnO2不溶于水,而KCl溶于水所以可按溶解、过滤、洗涤、烘干顺序回收MnO2;在过滤、蒸发操作中都要用到玻璃棒;
(6)若6.5g都是锌可生成氢气0.2g,而6.5g含杂质的锌也生成0.2gH2,说明杂质也有与酸反应金属存在.再由规律:相同价态、相同质量不同种金属与足量的酸反应相对原子质量越小产生的氢气越多,做出推断.
解答:解:(1)用氯酸钾和二氧化锰反应制取氧气需要加热反应,我们可选用B作为发生装置;又因氧气的密度大于空气的密度,并且不易溶于水,可选C或D作为收集装置;反应式是:2KMnO4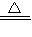 K2MnO4+MnO2+O2↑;大理石与稀盐酸反应制取二氧化碳,是固液在常温下反应,可用装置A作为发生装置;二氧化碳密度大于空气的密度,易溶于水,我们用装置D收集;又因为要收集干燥的二氧化碳,所以要在AD之间连接装置E.
K2MnO4+MnO2+O2↑;大理石与稀盐酸反应制取二氧化碳,是固液在常温下反应,可用装置A作为发生装置;二氧化碳密度大于空气的密度,易溶于水,我们用装置D收集;又因为要收集干燥的二氧化碳,所以要在AD之间连接装置E.
具体内容如下表:
(2)根据装置I、Ⅱ的导管进出口顺序可知,装置Ⅱ只能用来收集难溶于水或密度比空气小的气体,因此利用装置I、Ⅱ可收集H2.故选②;
(3)反应物是过氧化钠(Na2O2)与水,生成物是氧气和氢氧化钠,此反应的化学式是:2Na2O2+2H2O═4NaOH+O2↑;因氧气不易溶于水,可用排水法收集,改进措施是:将装置Ⅱ中装满水,打开K1,关闭K2(也就是用排水法收集氧气);
故答案为:2Na2O2+2H2O═4NaOH+O2;将装置Ⅱ中装满水,打开K1,关闭K2(也就是用排水法收集氧气).
(4)检验水一般用无水硫酸铜,无水硫酸铜遇水变蓝.故答案为:无水硫酸铜、白色粉末变成蓝色;
(5)①从KCl和MnO2混合物中回收二氧化锰,根据MnO2不溶于水,而KCl溶于水所以可按溶解、过滤、洗涤、烘干顺序回收
MnO2;
②氯化钾晶体配制50g质量分数为5%的氯化钾溶液,需要氯化钾的质量为:50×5%=2.5g;
③在过滤、蒸发操作中都要用到玻璃棒,过滤实验中要用玻璃棒引流;蒸发实验中要用玻璃棒搅拌.
故答案为:①bcda;②2.5g;③C(顺序颠倒、不带单位均不给分);
(6)根据反应式计算:
设:假设6.5g金属都是锌时,可生成氢气Xg
Zn+H2SO4=ZnSO4+H2↑
65 2
6.5 X
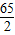 =
=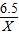
X=0.2g
可知6.5g都是锌可生成氢气0.2g,而6.5g含杂质的锌也生成0.2gH2,说明杂质也有与酸反应金属存在,但考虑到铝、铁、镁的相对原子质量都比锌小,再由规律:相同价态、相同质量不同种金属与足量的酸反应相对原子质量越小产生的氢气越多,由此推知,杂质至少由两种金属组成,且每种组成中都含有Cu.故答案为:Cu.
点评:本题综合考查了学生的基本实验能力,涉及装置选择、连接、实验基本操作、化学计算等知识.要同学们具有综合的化学知识方可做好此题.
(2)观察图示可知是固液在常温下的反应,并且收集气体的密度应小于空气的密度,然后选择即可;
(3)根据反应物是过氧化钠(Na2O2)与水,生成物是氧气和氢氧化钠写出化学反应式即可;因氧气不易溶于水,可用排水法收集.
(4)检验水一般用无水硫酸铜,无水硫酸铜遇水变蓝;
(5)从KCl和MnO2混合物中回收二氧化锰,根据MnO2不溶于水,而KCl溶于水所以可按溶解、过滤、洗涤、烘干顺序回收MnO2;在过滤、蒸发操作中都要用到玻璃棒;
(6)若6.5g都是锌可生成氢气0.2g,而6.5g含杂质的锌也生成0.2gH2,说明杂质也有与酸反应金属存在.再由规律:相同价态、相同质量不同种金属与足量的酸反应相对原子质量越小产生的氢气越多,做出推断.
解答:解:(1)用氯酸钾和二氧化锰反应制取氧气需要加热反应,我们可选用B作为发生装置;又因氧气的密度大于空气的密度,并且不易溶于水,可选C或D作为收集装置;反应式是:2KMnO4
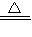 K2MnO4+MnO2+O2↑;大理石与稀盐酸反应制取二氧化碳,是固液在常温下反应,可用装置A作为发生装置;二氧化碳密度大于空气的密度,易溶于水,我们用装置D收集;又因为要收集干燥的二氧化碳,所以要在AD之间连接装置E.
K2MnO4+MnO2+O2↑;大理石与稀盐酸反应制取二氧化碳,是固液在常温下反应,可用装置A作为发生装置;二氧化碳密度大于空气的密度,易溶于水,我们用装置D收集;又因为要收集干燥的二氧化碳,所以要在AD之间连接装置E.具体内容如下表:
| 制取气体 | 所需药品 | 装置连接顺序 | 反应的化学方程式 |
| BC或BD | 2KMnO4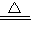 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑ | ||
| AED | CaCO3+2HCl=CaCl2+H2O+CO2↑ |
(3)反应物是过氧化钠(Na2O2)与水,生成物是氧气和氢氧化钠,此反应的化学式是:2Na2O2+2H2O═4NaOH+O2↑;因氧气不易溶于水,可用排水法收集,改进措施是:将装置Ⅱ中装满水,打开K1,关闭K2(也就是用排水法收集氧气);
故答案为:2Na2O2+2H2O═4NaOH+O2;将装置Ⅱ中装满水,打开K1,关闭K2(也就是用排水法收集氧气).
(4)检验水一般用无水硫酸铜,无水硫酸铜遇水变蓝.故答案为:无水硫酸铜、白色粉末变成蓝色;
(5)①从KCl和MnO2混合物中回收二氧化锰,根据MnO2不溶于水,而KCl溶于水所以可按溶解、过滤、洗涤、烘干顺序回收
MnO2;
②氯化钾晶体配制50g质量分数为5%的氯化钾溶液,需要氯化钾的质量为:50×5%=2.5g;
③在过滤、蒸发操作中都要用到玻璃棒,过滤实验中要用玻璃棒引流;蒸发实验中要用玻璃棒搅拌.
故答案为:①bcda;②2.5g;③C(顺序颠倒、不带单位均不给分);
(6)根据反应式计算:
设:假设6.5g金属都是锌时,可生成氢气Xg
Zn+H2SO4=ZnSO4+H2↑
65 2
6.5 X
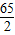 =
=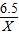
X=0.2g
可知6.5g都是锌可生成氢气0.2g,而6.5g含杂质的锌也生成0.2gH2,说明杂质也有与酸反应金属存在,但考虑到铝、铁、镁的相对原子质量都比锌小,再由规律:相同价态、相同质量不同种金属与足量的酸反应相对原子质量越小产生的氢气越多,由此推知,杂质至少由两种金属组成,且每种组成中都含有Cu.故答案为:Cu.
点评:本题综合考查了学生的基本实验能力,涉及装置选择、连接、实验基本操作、化学计算等知识.要同学们具有综合的化学知识方可做好此题.

练习册系列答案
相关题目
(2008?大庆)某含有杂质的Na2CO3固体(杂质不溶于水,也不与酸反应),老师安排同学做测定该固体混合物中Na2CO3质量分数的实验.利用电子天平测定的有关实验数据如下表:(装置见下图,不考虑水与氯化氢的挥发,锥形瓶的质量为27.30g)
(1)试通过分析计算固体混合物中Na2CO3的质量分数.
(2)请计算反应后溶液中溶质的质量分数.
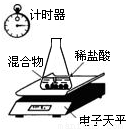
| 称 量 项 目 | 质量(g) |
| 杂质和Na2CO3的混合物 | 10.00 |
| 锥形瓶+稀盐酸(适量) | 141.20 |
| 锥形瓶+稀盐酸+杂质和Na2CO3的混合物(反应开始后15秒) | 149.20 |
| 锥形瓶+稀盐酸+杂质和Na2CO3的混合物(反应开始后35秒) | 149.00 |
| 锥形瓶+稀盐酸+杂质和Na2CO3的混合物(反应开始后55秒) | 149.00 |
(2)请计算反应后溶液中溶质的质量分数.