题目内容
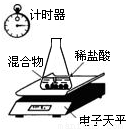
(2008?大庆)某含有杂质的Na2CO3固体(杂质不溶于水,也不与酸反应),老师安排同学做测定该固体混合物中Na2CO3质量分数的实验.利用电子天平测定的有关实验数据如下表:(装置见下图,不考虑水与氯化氢的挥发,锥形瓶的质量为27.30g)| 称 量 项 目 | 质量(g) |
| 杂质和Na2CO3的混合物 | 10.00 |
| 锥形瓶+稀盐酸(适量) | 141.20 |
| 锥形瓶+稀盐酸+杂质和Na2CO3的混合物(反应开始后15秒) | 149.20 |
| 锥形瓶+稀盐酸+杂质和Na2CO3的混合物(反应开始后35秒) | 149.00 |
| 锥形瓶+稀盐酸+杂质和Na2CO3的混合物(反应开始后55秒) | 149.00 |
(2)请计算反应后溶液中溶质的质量分数.
【答案】分析:由于含有杂质的Na2CO3固体中杂质不溶于水也不与酸反应,而碳酸钠可与盐酸放出二氧化碳而反应前后出现质量差,根据质量守恒定律,反应前后的质量差即为放出二氧化碳的质量;
根据碳酸钠与盐酸反应的化学方程式,可利用反应放出二氧化碳的质量计算参加反应的碳酸钠的质量和反应后生成的氯化钠的质量;
然后利用固体混合物中Na2CO3的质量分数= ×100%计算固体混合物中碳钠的质量分数,和反应后溶液中溶质的质量分数=
×100%计算固体混合物中碳钠的质量分数,和反应后溶液中溶质的质量分数= ×100%计算反应后所得氯化钠溶液的质量分数.
×100%计算反应后所得氯化钠溶液的质量分数.
解答:解:根据化学反应前后总质量相等知,生成CO2质量为:10g+141.2g-149.0g=2.2g
设生成2.2gCO2需要Na2CO3质量为x,同时生成NaCl的质量为y,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 2.2g
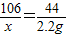 解得x=5.3g
解得x=5.3g
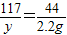 解得y=5.85g
解得y=5.85g
则固体混合物中Na2CO3的质量分数=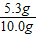 ×100%=53%
×100%=53%
反应后溶液中溶质的质量分数=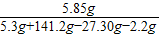 ×100%=5%
×100%=5%
答:(1)固体混合物中Na2CO3的质量分数53%;(2)反应后溶液中溶质的质量分数5%.
点评:本题主要考查有关化学方程式、溶液计算以及质量守恒定律运用等知识综合计算.解题的关键是能够灵活运用质量守恒定律求出生成的二氧化碳质量.
根据碳酸钠与盐酸反应的化学方程式,可利用反应放出二氧化碳的质量计算参加反应的碳酸钠的质量和反应后生成的氯化钠的质量;
然后利用固体混合物中Na2CO3的质量分数=
 ×100%计算固体混合物中碳钠的质量分数,和反应后溶液中溶质的质量分数=
×100%计算固体混合物中碳钠的质量分数,和反应后溶液中溶质的质量分数= ×100%计算反应后所得氯化钠溶液的质量分数.
×100%计算反应后所得氯化钠溶液的质量分数.解答:解:根据化学反应前后总质量相等知,生成CO2质量为:10g+141.2g-149.0g=2.2g
设生成2.2gCO2需要Na2CO3质量为x,同时生成NaCl的质量为y,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
x y 2.2g
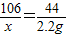 解得x=5.3g
解得x=5.3g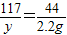 解得y=5.85g
解得y=5.85g则固体混合物中Na2CO3的质量分数=
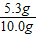 ×100%=53%
×100%=53%反应后溶液中溶质的质量分数=
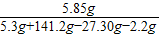 ×100%=5%
×100%=5%答:(1)固体混合物中Na2CO3的质量分数53%;(2)反应后溶液中溶质的质量分数5%.
点评:本题主要考查有关化学方程式、溶液计算以及质量守恒定律运用等知识综合计算.解题的关键是能够灵活运用质量守恒定律求出生成的二氧化碳质量.

练习册系列答案
相关题目
(2008?大庆)某校化学研究性学习小组探究气体制取的实验原理与方法.
(1)甲同学将课本的基础知识进行整理如图,请你帮助他完成相关内容.
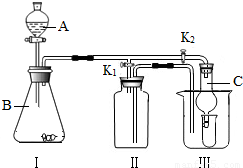
(2)乙同学设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.当打开K1、关闭
K2时,利用I、Ⅱ装置可直接进行的实验是______(填序号).
①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丙同学认为在不改变I、Ⅱ、Ⅲ装置的仪器及
位置的前提下,该装置可用于过氧化钠(Na2O2)与水反应制取氧气,另一产物为氢氧化钠,则该反应的化学方程式为:______;她的改进措施是______.
(4)丁同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时C中盛放的物质是______,可以观察到的现象是______.
(5)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰.正确操作的先后顺序是______(填写选项序号).
a.烘干b.溶解c.过滤d.洗涤
②用所得氯化钾晶体配制50g质量分数为5%的氯化钾溶液,需要氯化钾的质量为______.
③过滤、蒸发时都需用到的仪器是______(填序号).
A.酒精灯B.烧杯C.玻璃棒D.漏斗E.量筒
(6)小明用6.5g可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成0.2g氢气,则此锌粉中一定含有的金属杂质是______.
(1)甲同学将课本的基础知识进行整理如图,请你帮助他完成相关内容.

| 制取气体 | 所需要品 | 装置连接顺序 | 反应的化学方程式 |
| 氧气 | 氯酸钾和二氧化锰 | ||
| 二氧化碳(干燥) | 大理石和稀盐酸 |
K2时,利用I、Ⅱ装置可直接进行的实验是______(填序号).

①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丙同学认为在不改变I、Ⅱ、Ⅲ装置的仪器及
位置的前提下,该装置可用于过氧化钠(Na2O2)与水反应制取氧气,另一产物为氢氧化钠,则该反应的化学方程式为:______;她的改进措施是______.
(4)丁同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时C中盛放的物质是______,可以观察到的现象是______.
(5)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰.正确操作的先后顺序是______(填写选项序号).
a.烘干b.溶解c.过滤d.洗涤
②用所得氯化钾晶体配制50g质量分数为5%的氯化钾溶液,需要氯化钾的质量为______.
③过滤、蒸发时都需用到的仪器是______(填序号).
A.酒精灯B.烧杯C.玻璃棒D.漏斗E.量筒
(6)小明用6.5g可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成0.2g氢气,则此锌粉中一定含有的金属杂质是______.