题目内容
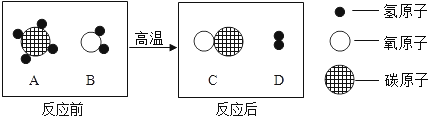
【题目】现欲探究一固体混合物A的成分,已知其中可能含有NaC1、Na2CO3、CuO、BaSO4四种物质中的两种或多种。按图所示进行实验,出现的现象如图所示(设过程中所有可能发生的反应均恰好完全反应)。
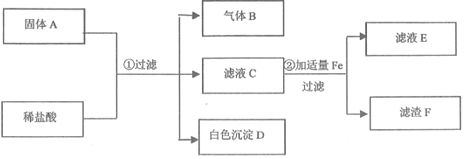
试根据实验过程和发生的现象填写以下空白:
(1)气体B是_____(写化学式)。
(2)白色沉淀D是_____(写化学式)。
(3)写出过程①中生成气体B的化学方程式_____。
(4)写出过程②滤液C中加适量Fe后发生反应的化学方程式_____。
(5)固体混合物A中一定存在的物质共_____种。
【答案】CO2; BaSO4; Na2CO3+2HCl=2NaCl+H2O+CO2↑; CuCl2+Fe=FeCl2+Cu; 3。
【解析】
硫酸钡不溶于水、不溶于酸,碳酸钠和盐酸反应会生成二氧化碳,氧化铜和盐酸反应生成氯化铜和水,所以固体A中加入稀盐酸,得到白色沉淀D,所以D是硫酸钡沉淀,会生成无色气体B,所以B是二氧化碳,滤液C会与铁反应生成滤液E和滤渣F,所以C是氯化铜,E是氯化亚铁,F是铜,所以(1)气体B是CO2;
(2)白色沉淀D是BaSO4;
(3)过程①中生成气体B的反应是碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(4)过程②滤液C中加适量Fe后发生的反应是氯化铜和铁反应生成氯化亚铁和铜,化学方程式为:CuCl2+Fe=FeCl2+Cu;
(5)固体混合物A中一定存在的物质共碳酸钠、铁、硫酸钡3种。

【题目】取四份大理石样品分别和稀盐酸反应,实验数据记录如下表。(杂质既不溶于水也不跟酸反应)
第1份 | 第2份 | 第3份 | 第4份 | |
大理石样品质量(g) | 3.0 | 3.0 | 3.0 | 3.0 |
稀盐酸质量(g) | 5.0 | 10.0 | 15.0 | 20.0 |
产生气体质量(g) | 0.44 | 0.88 | 0.99 | X |
回答下列有关问题:
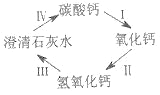
(1)仔细观察第1份和第2份实验数据,会发现生成气体的质量不相同。据此判断,在第1份样品的实验中,_____(填“大理石”或者“稀盐酸”)完全反应;生成的气体通入澄清石灰水中,发生反应的化学方程式为_____;
(2)同理,比较第2份和第3份实验数据,可以判断其中第_____份大理石样品反应完全。那么,第4份数据中的x值应该为_____;
(3)计算:该大理石样品中碳酸钙的质量分数。___(依据化学方程式,写出计算过程)