题目内容
(7 分)小明上网阅读时得知根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量(Ar)的实验。小明很感兴趣,和化学兴趣小组的同学设计了如下探究活动,请结合下图回答问题。

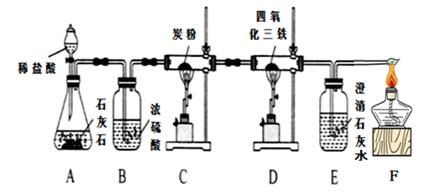
(1)实验室利用氯化铵和氢氧化钙固体之间的复分解反应制取氨气。小明将A与E连接,观察到无色酚酞试液变红,说明氨气显 (填“酸性”、“中性”、或“碱性”)。A中发生反应的化学方程式为 。
(2)小刚将纯净干燥的氨气通入B中,观察到玻璃管内黑色固体变为亮红色,管口有液滴,同时生成空气中含量最多的气体,B中发生反应的化学方程式为 。
(3)小组同学测定铜元素相对原子质量(Ar)的实验设想是:先称量反应物CuO的质量M(CuO),反应完全后测定生成物水的质量M(H2O),由此计算出Cu的相对原子质量。
①小组每位同学从所提供的仪器中选择并组装了一套用于本实验的装置,其中简单、合理的是(填序号,装置可重复使用) 。
A.acdbbeecd B.aeebbcdee C.aeebbeecd D.abbeecd
②在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
A.CuO未完全起反应
B.CuO不干燥
C.氢氧化钠固体不干燥
D.CuO中混有不反应的杂质
E.NH4C1与Ca(OH)2混合物不干燥
③在本实验中,还通过测定_______________和_____________的质量达到目的。

(1)实验室利用氯化铵和氢氧化钙固体之间的复分解反应制取氨气。小明将A与E连接,观察到无色酚酞试液变红,说明氨气显 (填“酸性”、“中性”、或“碱性”)。A中发生反应的化学方程式为 。
(2)小刚将纯净干燥的氨气通入B中,观察到玻璃管内黑色固体变为亮红色,管口有液滴,同时生成空气中含量最多的气体,B中发生反应的化学方程式为 。
(3)小组同学测定铜元素相对原子质量(Ar)的实验设想是:先称量反应物CuO的质量M(CuO),反应完全后测定生成物水的质量M(H2O),由此计算出Cu的相对原子质量。
①小组每位同学从所提供的仪器中选择并组装了一套用于本实验的装置,其中简单、合理的是(填序号,装置可重复使用) 。
A.acdbbeecd B.aeebbcdee C.aeebbeecd D.abbeecd
②在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
A.CuO未完全起反应
B.CuO不干燥
C.氢氧化钠固体不干燥
D.CuO中混有不反应的杂质
E.NH4C1与Ca(OH)2混合物不干燥
③在本实验中,还通过测定_______________和_____________的质量达到目的。
(1)碱性 ; Ca(OH)2 +2NH4Cl 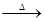 CaCl2 +2H2O+ 2NH3↑
CaCl2 +2H2O+ 2NH3↑
(2)3CuO + 2NH3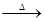 3Cu + N2 + 3H2O
3Cu + N2 + 3H2O
(3)①C ②AD ③CuO Cu
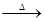 CaCl2 +2H2O+ 2NH3↑
CaCl2 +2H2O+ 2NH3↑(2)3CuO + 2NH3
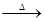 3Cu + N2 + 3H2O
3Cu + N2 + 3H2O(3)①C ②AD ③CuO Cu
试题分析:(1)根据氨气能使无色酚酞试液变红,可判断氨气呈碱性;氢氧化钙与氯化铵在加热的条件下反应,生成氯化钙和氨水,由于氨水易分解生成氨气和水,故反应的化学方程式Ca(OH)2+2NH4Cl△CaCl2 +2H2O+ 2NH3↑;
(2)将纯净干燥的氨气通入装有氧化铜的玻璃管,加热,观察到玻璃管内黑色固体氧化铜变为亮红色(说明有铜生成),管口有液滴(根据元素守恒可知,有水生成),同时生成空气中含量最多的气体(氮气),因此该反应的化学方程式为3CuO + 2NH3△ 3Cu + N2 + 3H2O;
(3)①根据实验设想,实验中需要测定反应生成水的质量,因此在把氨气通入氧化铜前应使用不能与氨气发生反应的氢氧化钠进行干燥,并把还原氧化铜后生成的水仍用不能吸收多余氨气的氢氧化钠吸收,反应后多余的氨气要使用浓硫酸处理,以防止造成空气污染,因此所组成的装置连接方式为C;
②根据反应的化学方程式,设测定的氧化铜质量为A、生成水的质量为B,设铜的相对原子质量为m
3CuO + 2NH3△ 3Cu + N2 + 3H2O
3m+48 54
A B
(3m+48):54=A:B
解得m=
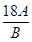 -16
-16即铜的相对原子质量与测定的氧化铜的质量成正比,而与测定的水的质量成反比,因此:
A.CuO未完全起反应,会导致生成水的质量偏小;
B.CuO不干燥,加热过程水分蒸发,会导致测得水的质量偏大;
C.氢氧化钠固体不干燥,对水的吸收与测量不受影响;
D.CuO中混有不反应的杂质,生成水的质量相对偏小;
E.NH4C1与Ca(OH)2混合物不干燥,对氨气还原氧化铜的实验不产生影响;故导致测定结果偏大的因素为AD。
③根据反应的化学方程可发现,通过测定氧化铜与铜或铜与水等质量,皆能计算出铜元素的相对原子质量。
点评:对于探究型实验探究,要熟悉实验探究的环节和方法,精心设计实验方案,将所学过探究物质的性质或变化规律的技巧迁移至此,进行细心地探究实验和观察现象,再通过分析实验现象,推断、总结出该物质的性质或变化规律等。

练习册系列答案
相关题目

 氧气
氧气 氧化物甲”的转化,反应I的化学方程式为 。
氧化物甲”的转化,反应I的化学方程式为 。