题目内容
【题目】化学兴趣小组的同学为了测定某赤铁矿石中氧化铁的质量分数。
Ⅰ.甲同学取一定质量的赤铁矿粉与过量的木炭粉混合后,用下图所示装置以合理的操作步骤测定(假设杂质始终不发生变化);反应生成单质铁和二氧化碳,以及少量的一氧化碳。
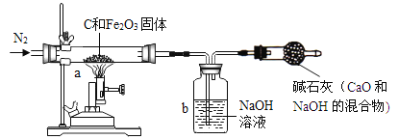
(1) 实验中持续通入干燥的氮气。加热前缓缓通入一段时间,其作用是 。
(2)反应结束后,甲同学熄灭了喷灯的火焰后,马上停止通入N2,他这样操作引起的后果
是 。
(3)如果b装置中氢氧化钠溶液对二氧化碳的吸收是完全的,那么甲同学用b装置中氢氧
化钠溶液的质量变化测定出氧化铁的质量分数将 (选填“偏大”、“偏小”
或“准确”)。
Ⅱ.乙同学取氧化铁的质量分数为80%的赤铁矿粉10g,加入足量稀盐酸,恰好完全反应,
共用去稀盐酸154.5g(假设杂质既不溶于水也不与酸发生反应)。
试计算反应后溶液中溶质的质量分数。(请写出计算过程)
【答案】(1)将装置内的空气排尽(2)b中的NaOH溶液会倒吸入a中造成硬质玻璃管
破裂(或生成的铁重新被氧化) (3)偏小
【解析】
试题分析:(1)用一氧化碳还原氧化铁,要先把装置内的空气排尽,目的是防止爆炸;
(2)反应结束后,要等试管冷却后再停止通氮气,目的是防止生成的生成的铁重新被氧化;
(3)由于碳和氧化铁反应也可能产生一氧化碳,不会被吸收,故测定出氧化铁的质量分数将偏小。
利用化学方程式氧化铁与氯化铁的质量比可求出氯化铁的质量;
解:设反应生成FeCl3质量为x。
Fe2O3+6HCl═2FeCl3+3H2O
160325
10g×80%x
X=(325×8g)/160=16.25g
溶液中FeCl3的质量分数=16.25g/(154.5g+8g)×100%=10%
答:反应后溶液中氯化铁的质量分数分别是10%

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目