题目内容
【题目】氢化钙(CaH2)是种白色细颗粒状固体,能与水发生剧烈反应,其反应的化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,常用作登山运动员的能源提供剂。某化学实验小组为了探究氢化钙的性质,将一定量的CaH2加入到碳酸钠溶液中,立即产生大量气泡,且溶液变浑浊。充分反应后过滤,得到滤渣和滤液,滤渣的主要成分是________(填写化学式)。
为进步确定滤液中所含溶质的成分,他们进行了以下实验探究。
(提出猜想)猜想一:NaOH: 猜想二:NaOH和Na2CO3;
猜想三:________________; 猜想四:NaOH、Na2CO3、Ca(OH)2
经过分析,大家一致认为上述猜想_______不需要验证,肯定是错误的,原因是(用化学方程式表示)___________________________。
(实验探究)
方案一:取一定量的滤液于试管中,往其中滴加少量稀盐酸,无明显实验现象。
方案二:取一定量的滤液于另一试管中,往其中滴加氯化钡溶液,观察到有白色沉淀产生。
(讨论交流)根据实验现象,得出猜想________是正确的。请解释方案一中无明显现象的原因是_____________________________。
(拓展探究)上述小组同学将5g氢化钙样品(所含杂质不参与反应也不溶于水)加入到50g碳酸钠溶液中,充分混合后,恰好完全反应。实验测得反应过程中产生气体的质量为0.4g。计算:
(1)样品中CaH2的质量分数为____。
(2)原碳酸钠溶液中溶质的质量为____。
(3)反应后溶液中溶质的质量分数为____。(计算结果保留一位小数)
【答案】CaCO3 NaOH、Ca(OH)2 四 Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ 二 稀盐酸的量很少,先全部与氢氧化钠反应了 84% 10.6g 18.3%
【解析】
将一定量的CaH2加入到碳酸钠溶液中,氢化钙先与水发生剧烈反应,其反应的化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,然后碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠。充分反应后过滤,得到滤渣和滤液,滤渣的主要成分是CaCO3。
提出猜想:
猜想一:NaOH;猜想二:碳酸钠过量,NaOH和Na2CO3;猜想三:氢化钙过量,NaOH、Ca(OH)2;猜想四:NaOH、Na2CO3、Ca(OH)2;猜想四不需要验证,肯定是错误的,原因是碳酸钠和氢氧化钙不能共存,化学方程式为:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓。
讨论交流:
方案一:取一定量的滤液于试管中,往其中滴加少量稀盐酸,无明显实验现象。因为稀盐酸为少量的,所以可能溶液中的存在氢氧化钠先和稀盐酸反应,所以不能判断三个猜测是否正确。
方案二:取一定量的滤液于另一试管中,往其中滴加氯化钡溶液,观察到有白色沉淀产生,生成的色沉淀是碳酸钠和氯化钡反应生成的碳酸钡沉淀。故猜想二正确。
拓展探究:
上述小组同学将5g氢化钙样品(所含杂质不参与反应也不溶于水)加入到50g碳酸钠溶液中,充分混合后,恰好完全反应。实验测得反应过程中产生气体的质量为0.4g。
解:设氢化钙样品中氢化钙的质量为x,生成的氢氧化钙的质量为y,参与反应的碳酸钠的质量为z,生成的氢氧化钠为m,生成碳酸钙的质量为n,
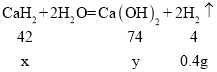
![]() ,解得x=4.2g,y=7.4g,杂质=5g-4.2g=0.8g,样品中CaH2的质量分数为
,解得x=4.2g,y=7.4g,杂质=5g-4.2g=0.8g,样品中CaH2的质量分数为![]() =84%。
=84%。
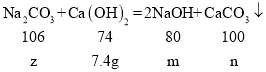
z=10.6g,m=8g,n=10g,故原碳酸钠溶液中溶质的质量为10.6g,反应后放入溶质为氢氧化钠,反应后溶液中溶质的质量分数为![]() ×100%
×100%![]() 18.3%。
18.3%。
答:(1)样品中CaH2的质量分数为84%。
(2)原碳酸钠溶液中溶质的质量为10.6g。
(3)反应后溶液中溶质的质量分数为18.3%。

 阅读快车系列答案
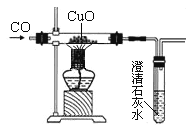
阅读快车系列答案【题目】已知氧化铜还原成铜的过程中有氧化亚铜生成。如图是小华同学用CO还原氧化铜的实验装置图,当玻璃管中黑色物质全部变红后,小华想知道红色物质中有哪些成分?请你与小华一起完成下面的探究。
【提出猜想】①全部是铜; ②全部是氧化亚铜;③是铜和氧化亚铜的混合物。
【查阅资料】氧化亚铜是一种红色固体,能与稀硫酸发生如下反应:
Cu2O+H2SO4=Cu+CuSO4+H2O
【设计实验】为了验证这些猜想,小华同学进行了以下探究活动,请完成下列问题:
步骤 | 现象或数据 | 结论 |
(1)称取14.4g反应生成的红色固体于试管中,向其中加入足量的稀硫酸; | 现象:_______; | 猜想①错误 |
(2)将步骤(1)反应后的物质进行过滤,称量干燥后的固体质量为m。 | 数据: 若m = 6.4g; | ________ |
数据:若m_______6.4g (填:>、<或=)。 | 猜想③正确 |
【交流反思】(1)小华实验装置中的石灰水的主要作用是______________________________,从环保角度看,该装置有待改进,请写出一种改进措施_____________________________。
(2)请写出氧化铜与CO反应生成氧化亚铜的化学方程式_________________________。
【题目】兴趣小组同学为了测定某中碳酸钙的质量分数,称取25.0g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体的重复操作(杂质不参加反应),记录数据如下:
操作次数 | 第1次 | 第2次 | 第3次 | 第4次 |
剩余固体质量(g) | 21.6 | 19.2 | 16.2 | 16.2 |
试计算:
(1)完全反应后生成二氧化碳的质量是__g。
(2)求珍珠粉中碳酸钙的质量分数。(写出计算过程)__________.