题目内容
二氧化碳是一种奇妙的气体,某校化学兴趣小组在老师指导下,进行了《实验室二氧化碳的制取及其性质》实验,请你帮助回答下列问题.(1)在大试管中加入5粒石灰石、倾倒约试管体积三分之一的稀盐酸(1:1),取一支中试管用排空气法收集CO2,验满,另一支中试管用排水法收集CO2,集满.发现______
先收集满.该操作过程中合理的排列顺序是(选填序号)______.
①检验装置的气密性 ②待有连续稳定气泡再排水集气
③将水槽中待收集气体的小试管注满水 ④旋紧连有导管的单孔胶塞
⑤向大试管内5粒石灰石再倒入三分之一的盐酸(1:1)
(2)实验时用大试管与带导管的单孔胶塞制取二氧化碳气体,______
______说明该装置气密性良好,制取该气体发生的化学方程式是______.此装置还可以制取______气体,制气反应的化学方程式是______ 2H2O+O2↑
【答案】分析:(1)根据二氧化碳能溶于水且能与水反应生成碳酸,进行分析解答;
根据实验室制取二氧化碳的具体操作步骤和注意事项分别是:连→查(检查装置的气密性)→加(加入固体药品)→倒(倒入液体药品;注意长颈漏斗的下端要浸在液面下)→收集,进行解答;
(2)根据装置的气密性的检查方法,进行解答;
根据化学方程式的书写步骤:写配注等,写出反应方程式;依据气体制取的反应原理进行解答;
(3)根据收集方法排水法及弯管伸入试管内的注意事项:伸入试管内的弯管不易太长,否则收集不满试管;
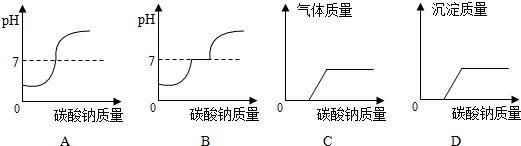
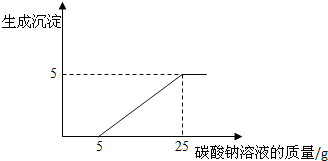
(4)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明碳酸钠并没有和氯化钙反应,滤液中的溶质除含有CaCl2外,还含有盐酸,由图意,Na2CO3溶液与氯化钙溶液全部反应,生成5 g碳酸钙沉淀,要计算碳酸钠溶液中溶质的质量分数,可根据生成沉淀的质量为5g,求出碳酸钠的质量,而这些碳酸钠是20g碳酸钠溶液中的碳酸钠的质量,就不难求出质量分数了.
解答:解:(1)根据二氧化碳能溶于水且能与水反应生成碳酸,因此排空气法先集满;
根据实验室制取二氧化碳的具体操作步骤和注意事项可得,操作过程中合理的排列顺序是:①③⑤④②(或③①⑤④②);
(2)根据装置的气密性的检查方法:先将大试管与带导管的单孔胶塞连接,再将导管末端浸入水中,然后用手捂住试管一会儿,导管口有气泡,放手后导管内倒吸入一段水柱;
根据化学方程式的书写步骤:写配注等,制取二氧化碳反应方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
依据气体制取的反应原理该发生装置还可制取氧气,反应方程式为:2H2O2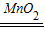 2H2O+O2↑;
2H2O+O2↑;
原因为:该反应为固体和液体不需加热的反应,与制二氧化碳的反应状态和条件相同,故可用制二氧化碳的装置(其他合理解答均可);
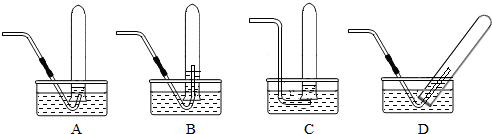
(3)根据收集方法排水法及弯管伸入试管内的注意事项:伸入试管内的弯管不易太长,否则收集不满试管;
故选AC;
(4)分析1:在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明碳酸钠并没有和氯化钙反应,滤液中的溶质除含有CaCl2外,还含有盐酸,含有的微粒是:H+、Cl-、H2O;
向该“混合液”中加入 碳酸钙固体可变成主要含氯化钙的中性溶液;
分析2:分析图意,Na2CO3溶液与氯化钙溶液全部反应,生成5 g碳酸钙沉淀
设:20gNa2CO3溶液中溶质的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x 5g

X═5.3g
该Na2CO3溶液中溶质的质量分数为 ×100%=26.5%;
×100%=26.5%;
故答案为:
(1)①③⑤④②(或③①⑤④②)
(2)先将大试管与带导管的单孔胶塞连接,再将导管末端浸入水中,然后用手捂住试管一会儿,导管口有气泡,放手后导管内倒吸入一段水柱;
CaCO3+2HCl═CaCl2+H2O+CO2↑; 氧气;2H2O2 2H2O+O2↑;
2H2O+O2↑;
该反应为固体和液体不需加热的反应,与制二氧化碳的反应状态和条件相同,故可用制二氧化碳的装置(其他合理解答均可)
(3)AC
(4)分析1:H+、Cl- H2O; 碳酸钙固体;
分析2:26.5%.
点评:本题考查学生对制取气体的反应原理、收集方法的理解与掌握;根据反应的化学方程式能表示反应中各物质的质量关系,由反应中某物质的质量可计算出反应中其它物质的质量.
根据实验室制取二氧化碳的具体操作步骤和注意事项分别是:连→查(检查装置的气密性)→加(加入固体药品)→倒(倒入液体药品;注意长颈漏斗的下端要浸在液面下)→收集,进行解答;
(2)根据装置的气密性的检查方法,进行解答;
根据化学方程式的书写步骤:写配注等,写出反应方程式;依据气体制取的反应原理进行解答;
(3)根据收集方法排水法及弯管伸入试管内的注意事项:伸入试管内的弯管不易太长,否则收集不满试管;
(4)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明碳酸钠并没有和氯化钙反应,滤液中的溶质除含有CaCl2外,还含有盐酸,由图意,Na2CO3溶液与氯化钙溶液全部反应,生成5 g碳酸钙沉淀,要计算碳酸钠溶液中溶质的质量分数,可根据生成沉淀的质量为5g,求出碳酸钠的质量,而这些碳酸钠是20g碳酸钠溶液中的碳酸钠的质量,就不难求出质量分数了.
解答:解:(1)根据二氧化碳能溶于水且能与水反应生成碳酸,因此排空气法先集满;
根据实验室制取二氧化碳的具体操作步骤和注意事项可得,操作过程中合理的排列顺序是:①③⑤④②(或③①⑤④②);
(2)根据装置的气密性的检查方法:先将大试管与带导管的单孔胶塞连接,再将导管末端浸入水中,然后用手捂住试管一会儿,导管口有气泡,放手后导管内倒吸入一段水柱;
根据化学方程式的书写步骤:写配注等,制取二氧化碳反应方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
依据气体制取的反应原理该发生装置还可制取氧气,反应方程式为:2H2O2
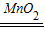 2H2O+O2↑;
2H2O+O2↑;原因为:该反应为固体和液体不需加热的反应,与制二氧化碳的反应状态和条件相同,故可用制二氧化碳的装置(其他合理解答均可);
(3)根据收集方法排水法及弯管伸入试管内的注意事项:伸入试管内的弯管不易太长,否则收集不满试管;
故选AC;
(4)分析1:在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明碳酸钠并没有和氯化钙反应,滤液中的溶质除含有CaCl2外,还含有盐酸,含有的微粒是:H+、Cl-、H2O;
向该“混合液”中加入 碳酸钙固体可变成主要含氯化钙的中性溶液;
分析2:分析图意,Na2CO3溶液与氯化钙溶液全部反应,生成5 g碳酸钙沉淀
设:20gNa2CO3溶液中溶质的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x 5g

X═5.3g
该Na2CO3溶液中溶质的质量分数为
 ×100%=26.5%;
×100%=26.5%;故答案为:
(1)①③⑤④②(或③①⑤④②)
(2)先将大试管与带导管的单孔胶塞连接,再将导管末端浸入水中,然后用手捂住试管一会儿,导管口有气泡,放手后导管内倒吸入一段水柱;
CaCO3+2HCl═CaCl2+H2O+CO2↑; 氧气;2H2O2
 2H2O+O2↑;
2H2O+O2↑;该反应为固体和液体不需加热的反应,与制二氧化碳的反应状态和条件相同,故可用制二氧化碳的装置(其他合理解答均可)
(3)AC
(4)分析1:H+、Cl- H2O; 碳酸钙固体;
分析2:26.5%.
点评:本题考查学生对制取气体的反应原理、收集方法的理解与掌握;根据反应的化学方程式能表示反应中各物质的质量关系,由反应中某物质的质量可计算出反应中其它物质的质量.

练习册系列答案
相关题目
 二氧化碳是一种奇妙的气体,在实验室可以很方便的制取.
二氧化碳是一种奇妙的气体,在实验室可以很方便的制取.