题目内容
 二氧化碳是一种奇妙的气体,在实验室可以很方便的制取.
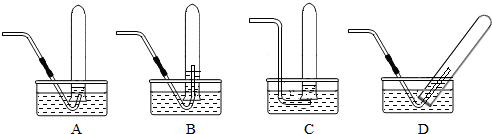
二氧化碳是一种奇妙的气体,在实验室可以很方便的制取.步骤一:选取药品与发生装置.实验室经常选用稀盐酸和
大理石或石灰石
大理石或石灰石
(填药品名称)作为反应物,发生装置可选用如上图中的B
B
.步骤二:检查装置气密性.组装好仪器后,将导管末端浸末在水中,用手捂试管,发现导管口
有气泡
有气泡
,放手后导管中有一小段水柱
导管中有一小段水柱
,则气密性良好.步骤三:反应并收集气体.收集二氧化碳可以用排水法或向上排空气法.到底哪种方法更好,甲、乙两同学分别用排水法和排空气法做如下实验研究(用的药品与发生装置一样)
| (1)比较收集时间:分别收集满一个集气瓶的二氧化碳,记录时间 | 甲:收集时间较短 乙:收集时间较长 |
原因: D D (选择填空,下同 ) |
| (2)比较收集到气体的浓度:分别朝两个集气瓶中加入两滴管的澄清石灰水 | 甲:石灰水先变浑浊后变澄清 乙:石灰水先变浑浊后变澄清且甲中石灰水恢复澄清的时间比乙 A A . |
原因: EF EF |
D.气态分子间隔大,运动速度快,不同气体分子更易混合,不易分离
E.过量的二氧化碳参与反应
F.甲收集到的二氧化碳纯度更高
结论:综上所述,
排水法
排水法
(填收集方法)收集二氧化碳更好.反思:排水法收集二氧化碳仍有不足之处,请写出一点
混有少量水蒸气
混有少量水蒸气
思考:丙同学对甲同学做完实验的废液进行了研究.
(1)测出该废液的pH<7,则废液中大量存在的阳离子为
Ca2+、H+
Ca2+、H+
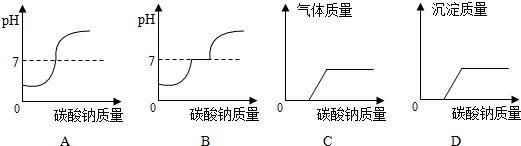
.(2)向此废液滴加碳酸钠溶液至过量,则下列图象表示正确的为
B
B
.
(3)若取此废液10g,向其中滴加过量的碳酸钠溶液20g,最多可以产生沉淀1g,气体0.44g,则所加碳酸钠溶液的溶质质量分数为
10.6%
10.6%
.分析:步骤一、运用二氧化碳的制取和制取装置的选择方法解答.
步骤二、运用检查装置气密性的方法是利用了气体压强的变化.
步骤三:运用对比实验来探究排水法和排空气法哪种方法好、运用分子的性质、二氧化碳能使澄清的石灰水变浑浊来解答.
结论:运用步骤三中的探究实验得出结论.
反思:运用排水法收集气体的方法的特点解答.
思考:(1)运用pH<7说明溶液呈酸性,结合碳酸钙和稀盐酸反应生成氯化钙、水、二氧化碳解答.
(2)运用碳酸钠和盐酸反应生成二氧化碳、氯化钙和碳酸钠反应产生碳酸钙沉淀解答.
(3)运用碳酸钠和盐酸反应、氯化钙和碳酸钠反应的化学方程式解答.
步骤二、运用检查装置气密性的方法是利用了气体压强的变化.
步骤三:运用对比实验来探究排水法和排空气法哪种方法好、运用分子的性质、二氧化碳能使澄清的石灰水变浑浊来解答.
结论:运用步骤三中的探究实验得出结论.
反思:运用排水法收集气体的方法的特点解答.
思考:(1)运用pH<7说明溶液呈酸性,结合碳酸钙和稀盐酸反应生成氯化钙、水、二氧化碳解答.
(2)运用碳酸钠和盐酸反应生成二氧化碳、氯化钙和碳酸钠反应产生碳酸钙沉淀解答.
(3)运用碳酸钠和盐酸反应、氯化钙和碳酸钠反应的化学方程式解答.
解答:解:步骤一:实验室运用大理石或石灰石与稀盐酸反应生成二氧化碳,常温下即可反应,大理石或石灰石是固体,盐酸是液体,故答案:大理石或石灰石; B
步骤二:检查装置的气密性用手握住容器外壁,导管口有气泡冒出,导管离开水面后容器内由于气压减小导管中有一段小水柱,故答案:有气泡; 导管中有一小段水柱
步骤三:对比实验来探究排水法和排空气法哪种方法好,结合题中提示故答案:
结论:由步骤三可得出运用排水法收集的气体较为纯净,故答案:排水法
反思:运用排水法收集二氧化碳是水蒸气会混入气体中,故答案:混有少量水蒸气
思考:(1)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳故,溶液中含有钙离子,由题意知溶液的pH<7说明溶液呈酸性.故(1)答案:Ca2+; H+
(2)滴加碳酸钠先和溶液中的酸反应,溶液的pH增大,再和溶液中的氯化钙反应生成碳酸钙沉淀和氯化钠在这一过程中溶液的pH不变等于7,氯化钙全参加反应后再加碳酸钠溶液的pH会大于7且增大,故(2)答案:B
(3)解:设与氯化钙反应的碳酸钠的质量为x,与稀盐酸反应的碳酸钠的质量为y
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x 1g
=
x=1.06g
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
y 0.44g
=
y=1.06g
故所加碳酸钠溶液的溶质质量分数为:
×100%=10.6%
故(3)答案:10.6%
步骤二:检查装置的气密性用手握住容器外壁,导管口有气泡冒出,导管离开水面后容器内由于气压减小导管中有一段小水柱,故答案:有气泡; 导管中有一小段水柱
步骤三:对比实验来探究排水法和排空气法哪种方法好,结合题中提示故答案:
| (1)比较收集时间: 分别收集满一个集气瓶的二氧化碳,记录时间 |
甲:收集时间较短 乙:收集时间较长 |
原因:D (选择填空,下同) |
| (2)比较收集到气体的浓度: 分别朝两个集气瓶中加入两滴管的澄清石灰水 |
甲:石灰水先变浑浊后变澄清 乙:石灰水先变浑浊后变澄清 且甲中石灰水恢复澄清的时间比乙 A. |
原因:EF |
反思:运用排水法收集二氧化碳是水蒸气会混入气体中,故答案:混有少量水蒸气
思考:(1)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳故,溶液中含有钙离子,由题意知溶液的pH<7说明溶液呈酸性.故(1)答案:Ca2+; H+
(2)滴加碳酸钠先和溶液中的酸反应,溶液的pH增大,再和溶液中的氯化钙反应生成碳酸钙沉淀和氯化钠在这一过程中溶液的pH不变等于7,氯化钙全参加反应后再加碳酸钠溶液的pH会大于7且增大,故(2)答案:B
(3)解:设与氯化钙反应的碳酸钠的质量为x,与稀盐酸反应的碳酸钠的质量为y
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x 1g
| 106 |
| x |
| 100 |
| 1g |
x=1.06g
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
y 0.44g
| 106 |
| y |
| 44 |
| 0.44g |
y=1.06g
故所加碳酸钠溶液的溶质质量分数为:
| 1.06g+1.06g |
| 20g |
故(3)答案:10.6%
点评:本题综合考查了实验室制取二氧化碳的知识、二氧化碳的性质、根据化学方程式的计算等知识,侧重知识的运用和计算能力的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目