题目内容
【题目】某化学兴趣小组进行以下实验:
【提出问题】实验一和实验二中,现象为何不同?
【查阅资料】氢氧化钠溶液和硫酸铜溶液反应会生成蓝色的氢氧化铜,但当硫酸铜溶液过量时,也会生成浅绿色的碱式硫酸铜。
(1)【分析讨论】
下列说法正确的是(填字母)。
A.加热实验一反应后生成的物质,出现黑色固体
B.实验二中生成了碱式硫酸铜
C.根据实验一和实验二可知,反应物相同时,反应物的量不同,产物可能不同
D.根据实验一和实验二可知,反应物相同时,反应条件不同,产物可能不同
(2)【继续探究】该小组同学对碱式硫酸铜产生了兴趣,通过以下实验探究碱式硫酸铜受热分解的产物。(已知:无水硫酸铜遇H2O变蓝;SO2能使酸性高锰酸钾溶液褪色。)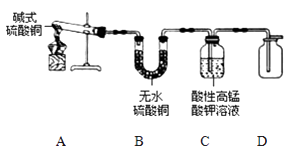
装置 | 操作及现象 | 分解产物 |
A | 试管中出现黑色固体,将黑色固体溶于稀硫酸,溶液呈蓝色 | |
B | U形管中出现蓝色固体 | |
C | 溶液颜色 | SO2 |
D | O2 |
(3)【拓展延伸】(A类学校选做A类题,B类学校选做B类题,C类学校选做C类题。)
(A类)若实验二中得到的碱式硫酸铜化学式为CuSO43Cu(OH)2 , 将该碱式硫酸铜浸泡在过量的氢氧化钠溶液中,密封放置一天后,固体全部变为蓝色。写出此反应的化学方程式:。
(B类)取12.9g某种碱式硫酸铜[化学式可表示为xCuSO4yCu(OH)2],加热完全分解后生成0.9g水,则x︰y =。
(C类)取2份等质量的某种碱式硫酸铜[化学式可表示为xCuSO4yCu(OH)2],一份加热完全分解后生成4.8g氧化铜,另一份可与20g质量分数为19.6%的稀硫酸恰好完全反应,则该碱式硫酸铜的化学式为。
【答案】
(1)A,B,C
(2)CuO,H2O,褪去,将带火星的木条伸入集气瓶中,木条复燃
(3)CuSO4?3Cu(OH)2+2NaOH = 4Cu(OH)2+Na2SO4,1︰1,CuSO4?2Cu(OH)2
【解析】加热实验一反应后生成的物质,出现黑色固体,因为碱式硫酸铜受热会分解产生氧化铜,因为开始是硫酸铜过量所以实验二中生成了碱式硫酸铜;根据实验一和实验二可知,反应物相同时,反应物的量不同,产物可能不同;该实验没有包含反应条件的变化,所以不能根据实验一和实验二可知,反应物相同时,反应条件不同,产物可能不同;试管中出现黑色固体,将黑色固体溶于稀硫酸,溶液呈蓝色,说明过程中产生氧化铜,U形管中出现蓝色固体说明产生水,因为无水硫酸铜遇到水会变为蓝色;溶液颜色褪去,说明产生二氧化硫,将带火星的木条伸入集气瓶中,木条复燃说明产生氧气。将该碱式硫酸铜浸泡在过量的氢氧化钠溶液中,密封放置一天后,固体全部变为蓝色。此反应的化学方程式CuSO43Cu(OH)2+2NaOH = 4Cu(OH)2+Na2SO4 ;
根据关系式得
xCuSO4yCu(OH)2---- | YH2O |
160X+98Y | 18Y |
12.9g | 0.9g |
列比例式得:(160X+98Y):12.9克=18Y:0.9克 解得X:Y=1:1.
设每份样品中碱式硫酸铜的质量为m
根据关系式得
xCuSO4yCu(OH)2---- | XCuO |
160X+98Y | 80X |
M | 4.8g |
xCuSO4yCu(OH)2 ------ | YH2SO4 |
160X+98Y | 98Y |
M | 20g×19.6% |
列比例式得:(160X+98Y):M=80X:4.8克 (160X+98Y):M=98Y:20g×19.6%
解得X=1 Y=2,所以化学式为CuSO42Cu(OH)2
【考点精析】本题主要考查了氧气的检验和验满和质量守恒定律及其应用的相关知识点,需要掌握氧气的验满:用带火星的木条放在集气瓶口;检验:用带火星的木条伸入集气瓶内;①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏才能正确解答此题.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案