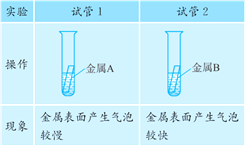
题目内容
【题目】溶液稀释的计算:
稀释前后溶质__________不变。
稀释后溶液质量=稀释前__________质量+所加水的质量。
【答案】质量 溶液
【解析】
稀释前后溶质质量不变。
稀释后溶液质量=稀释前溶液质量+所加水的质量。

【题目】某研究小组用下图所示装置,探究能否用镁条代替红磷测定空气中氧气含量。
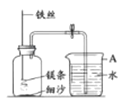
实验前,小组成员提出了不同的猜想。
【猜想与假设】
猜想1:可以代替,因为镁条与氧气反应后不会产生气体
猜想2:不能代替,查阅资料知金属镁很活泼,可能会与空气中的氮气反应
【进行实验】
步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装好装置后,打开止水夹,手捂集气瓶,一段时间后,松开手 | 烧杯中导管口有气泡冒出,松手后,烧杯中导管末端有一段液柱 |
Ⅱ | 关闭止水夹,点燃镁条,迅速伸入集气瓶中,塞好塞子 | 镁条燃烧,放出大量热,发出耀眼白光,生成大量白烟,剩余固体为白色带状物 |
Ⅲ | 冷却至室温,打开止水夹 | 烧杯中水从导管进入集气瓶中,体积约为集气瓶体积的2/5 |
【解释与结论】
(1)Mg与氧气反应的化学方程式为_________。
(2)步骤Ⅰ说明装置的气密性_________。
(3)步骤Ⅱ中,关闭止水夹的目的是_________。
(4)推测猜想2成立的现象证据是_________。
【反思与评价】
(5)该小组认为,即使步骤Ⅲ中水的体积恰好占集气瓶体积的1/5,也不能说明猜想1成立,理由是_________。
(6)小组中同学对镁条与瓶中气体的反应提出了进一步的猜想:甲同学认为镁条先与O2反应,乙同学认为镁条先与N2反应。为进一步检验他们的猜想,可以进行的实验操作是:取少量镁条,点燃后迅速放入盛有空气的集气瓶中,待镁条熄灭后,________。
【题目】某学习小组学习完碳的还原性后,对碳还原氧化铜后生成的气体是否一定是二氧化碳产生了怀疑.
【查阅资料】
①在本实验中为了保证实验成功,通过碳的质量是要过量的.
②被还原出来的铜在温度较高时很容易与空气中的氧气反应生成氧化铜.
③氮气不与碳、氧化铜产生反应,可用来隔绝空气(氧气).
(1)【提出问题】木炭还原氧化铜产生的是什么气体?
根据质量守恒定律可知,产生的气体有三种情况
①全部是CO2 ②全部是CO ③;
若猜想②成立,木炭还原氧化铜反应的化学方程式为: .
(2)【设计方案】由于二氧化碳可以被石灰水吸收面一氧化碳不能被石灰水吸收,从二氧化碳质量关系可以确定气体的组成.
【实验】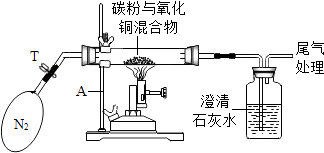
操作步骤及实验现象 | 简答 |
①称取0.8g氧化铜与0.2g碳粉均匀混合,放入重25g的玻璃管中,同时称得广口瓶和石灰水的总质量为500g,按图中装置连接 | / |
②加热前,先通一段时间纯净、干燥的氮气 | 其目的是 |
③夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊 | 澄清石灰水变浑浊的方程式为 |
④完全反应后,冷却至室温,称得玻璃管和固体总质量为25.5g | |
⑤称得广口瓶和石灰水的总质量为500.4g |
(3)【结论】根据数据处理结果,得出猜想成立.