题目内容
【题目】某学习小组学习完碳的还原性后,对碳还原氧化铜后生成的气体是否一定是二氧化碳产生了怀疑.
【查阅资料】
①在本实验中为了保证实验成功,通过碳的质量是要过量的.
②被还原出来的铜在温度较高时很容易与空气中的氧气反应生成氧化铜.
③氮气不与碳、氧化铜产生反应,可用来隔绝空气(氧气).
(1)【提出问题】木炭还原氧化铜产生的是什么气体?
根据质量守恒定律可知,产生的气体有三种情况
①全部是CO2 ②全部是CO ③;
若猜想②成立,木炭还原氧化铜反应的化学方程式为: .
(2)【设计方案】由于二氧化碳可以被石灰水吸收面一氧化碳不能被石灰水吸收,从二氧化碳质量关系可以确定气体的组成.
【实验】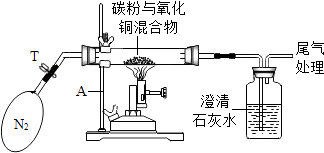
操作步骤及实验现象 | 简答 |
①称取0.8g氧化铜与0.2g碳粉均匀混合,放入重25g的玻璃管中,同时称得广口瓶和石灰水的总质量为500g,按图中装置连接 | / |
②加热前,先通一段时间纯净、干燥的氮气 | 其目的是 |
③夹紧T处弹簧夹,加热一段时间,澄清石灰水变浑浊 | 澄清石灰水变浑浊的方程式为 |
④完全反应后,冷却至室温,称得玻璃管和固体总质量为25.5g | |
⑤称得广口瓶和石灰水的总质量为500.4g |
(3)【结论】根据数据处理结果,得出猜想成立.
【答案】
(1)一氧化碳与二氧化碳的混合物,C+CuO ![]() CO↑+Cu
CO↑+Cu
(2)排走管内空气(氧气),CO2+Ca(OH)2═CaCO3↓+H2O
(3)③
【解析】【提出问题】根据质量守恒定律可知,产生的气体有三种情况:①全部是CO2;②全部是CO;③一氧化碳与二氧化碳的混合物;
若猜想②成立,则碳和氧化铜反应的化学化学方程式为:C+CuO ![]() CO↑+Cu;
CO↑+Cu;
【实验】由于碳能与空气中的氧气反应生成了二氧化碳.所以,先通入氮气能排出玻璃管内的空气,防止对实验造成干扰,目的是:排除玻璃管内空气对实验的干扰;
二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式是:CO2+Ca(OH)2=CaCO3↓+H2O
【结论】由于碳与氧化铜反应生成了铜和二氧化碳气体,根据质量守恒定律可得反应生成的气体质量为:25g+0.2g+0.8g﹣25.5g=0.5g.由题意可知,“集气瓶和石灰水的总质量为500g”、“称得集气瓶和石灰水的总质量为500.4g”,则可知生成二氧化碳的质量为0.4g,则0.5g气体中有一氧化碳.由上述计算分析可知,猜想③成立.
【考点精析】解答此题的关键在于理解质量守恒定律及其应用的相关知识,掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏,以及对书写化学方程式、文字表达式、电离方程式的理解,了解注意:a、配平 b、条件 c、箭号.