题目内容
【题目】现有A、B两种银白色的金属,某同学想要探究这两种金属的活动性。
【设计实验】
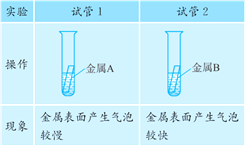
取大小相同的两块金属,用砂纸打磨光亮,分别放入两支试管中再加入等量的同种稀盐酸,操作与现象如下:
【思考结论】
(1)通过上述实验,判断出两种金属的活动性顺序是A________B(填“>”或“<”)。
(2)假设其中的一种金属是铁,除观察到铁的表面有气泡产生外,还能观察到反应后的溶液呈________(填“浅绿色”或“黄色”)。
(3)实验前用砂纸打磨金属片的目的是_____________________________________。
(4)如果两种金属是镁和铁,还可以用镁和一种化合物的溶液来证明两者的金属活动性强弱,你认为该化合物可以是_________________(填化学式)。
【答案】 < 浅绿色 去除表面的金属氧化物(或氧化膜) FeCl2(合理即可)
【解析】本题考查了金属活动性的探究,掌握金属活动性顺序并能灵活运用是解题的关键。
(1)金属活动性越强,与酸反应的速率越快。金属A与稀盐酸反应表面产生气泡较慢,金属B与稀盐酸反应表面产生气泡较快,则两种金属的活动性顺序是A<B;
(2)铁与稀盐酸反应生成氯化亚铁溶液和氢气,氯化亚铁溶液呈浅绿色,除观察到铁的表面有气泡产生外,还能观察到反应后的溶液呈浅绿色;
(3)金属的表面可能有与氧气反应生成的氧化物,用砂纸金属片,其目的是去除表面的金属氧化物(或氧化膜);
(4)如果两种金属是镁和铁,还可以用镁和一种化合物的溶液来证明两者的金属活动性强弱,镁的金属活动性比铁强,能与氯化亚铁溶液反应,说明的镁的金属活动性比铁强,可选用氯化亚铁溶液(合理即可),其化学式为FeCl2。

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目