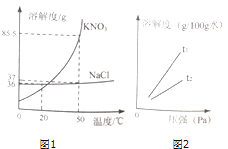
题目内容
【题目】海水晒盐工业流程中,得到的粗盐常含有MgCl2、CaCl2等杂质,工业提纯粗盐的流程如图所示: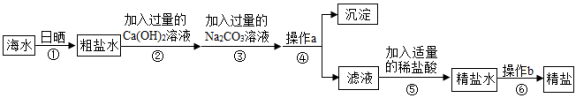
(1)步骤④操作a中需要用到玻璃棒,玻璃棒的作用是;
(2)步骤⑥中操作b的名称是:;
(3)如果将步骤②和步骤③的顺序颠倒,则所制得的精盐水中还含有 .
【答案】
(1)引流
(2)蒸发
(3)氯化钙
【解析】解:(1)步骤④操作a是将沉淀与滤液分离,该操作是过滤操作,玻璃棒的作用是引流.(2)步骤⑥中操作b是从精盐水中获得精盐,氯化钠的溶解度受温度影响变化不大,采用的是蒸发的方法.(3)步骤②和步骤③分别是加入过量的氢氧化钙溶液、碳酸钠溶液,分别是用于除去粗盐中的氯化镁、氯化钙的,但是加入碳酸钠溶液要放在加入的氢氧化钙溶液之后,这样碳酸钠会除去反应剩余的氢氧化钙;如果将步骤②和步骤③的顺序颠倒,过量的氢氧化钙与稀盐酸反应生成氯化钙,则所制得的精盐水中还含有氯化钙.
所以答案是:(1)引流;(2)蒸发;(3)氯化钙.
【考点精析】认真审题,首先需要了解过滤操作的注意事项(过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损),还要掌握蒸发操作的注意事项(蒸发注意点:1、在加热过程中,用玻璃棒不断搅拌2、当液体接近蒸干(或出现较多量固体)时停止加热,利用余热将剩余水分蒸发掉,以避免固体因受热而迸溅出来.3、热的蒸发皿要用坩埚钳夹取,热的蒸发皿如需立即放在实验台上,要垫上石棉网)的相关知识才是答题的关键.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】甲同学为了区别氢氧化钠和氢氧化钙溶液,设计了如图所示的四组实验方案. 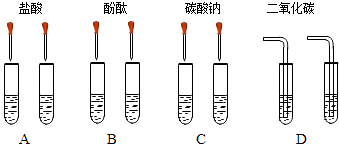
(1)其中能达到实验目的是
(2)在C组实验中发生的化学方程式为
(3)实验结束后,甲同学将A、C组四支试管中的溶液倒入同一容器中,看到溶液变浑浊,该现象说明有物质生成(填化学式),滴入酚酞后溶液呈红色.
(4)滴入酚酞后溶液呈红色,说明溶液呈碱性.使溶液呈碱性的物质是什么呢?甲同学进一步推测:溶液中呈碱性的物质可能是碳酸钠、氢氧化钙和三种物质中的一种,或是三种物质两两混合组成的混合物.
(5)为了验证推测,甲同学查阅资料,获悉氯化钡溶液呈中性,并设计如下实验加以验证.请根据要求完成下列空白:
实验内容 | 预测现象 | 结论 |
取少量容器中的上层溶液于试管中,加入过量的氯化钡溶液,静置 | ①若有白色沉淀,溶液呈无色 | 物质是碳酸钠 |
②若无沉淀生成,溶液呈红色 | 物质是氢氧化钙 | |
③若有白色沉淀,溶液呈红色 |
(6)乙同学认为甲同学第②步验证的结论不严密,原因是 .