题目内容
【题目】同学们在探究铁和铜的活动性时意外得知,铜和浓硫酸在加热的条件下反应有气体生成。对产生的气体,同学们产生了浓厚的探究兴趣。
(提出问题)铜与浓硫酸反应产生的气体是什么?
(作出猜想)猜想一:H2猜想二:SO2猜想三:H2和SO2的混合物
(查阅资料)二氧化硫可以使品红溶液褪色,能和碱溶液反应。
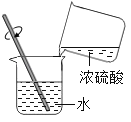
(实验探究)师生设计了如下装置进行实验(部分仪器省略)。
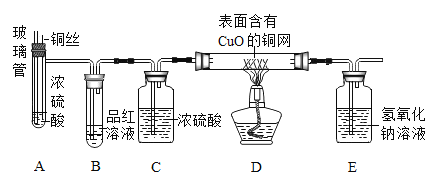
实验步骤 | 主要现象 | 解释或结论 |
①加热装置A一段时间 | B中的现象是____ | 有二氧化硫生成 |
②点燃装置D处酒精灯 | D玻璃管中无明显现象 | 猜想____正确 |
③停止加热,将铜丝上提,向装置A中玻璃管鼓入空气 |
|
|
(表达交流)
(1)步骤③中,鼓入空气的目的是_____。E中发生反应的化学方程式为_____。
(2)铜与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓))![]() CuSO4+SO2↑+2___。
CuSO4+SO2↑+2___。
(反思交流)
(1)根据以上探究,同学们设计了两种制取硫酸铜的实验方案:
![]()
小明认为方案②较好,你认为该方案较好的理由是_____。
(2)下列各组药品能够证明铁的活动性比铜强的是_____(填序号)。
①铁、硫酸铜溶液 ②铁、铜、稀硫酸 ③铁、铜、硫酸锌溶液
【答案】品红溶液褪色 二 将装置A中生成的二氧化硫气体全部排出 SO2+2NaOH=Na2SO3+H2O H2O 无污染、节约H2SO4(或节约药品) ①②
【解析】
实验步骤:①加热装置A一段时间 B中的现象是:品红溶液逐渐褪色,说明有二氧化硫生成;因为:二氧化硫可以使品红溶液褪色;
②点燃装置D处酒精灯,D玻璃管中无明显现象,说明没有氢气产生,猜想二正确;
(1)步骤③中,鼓入空气的目的是:将装置A中生成的二氧化硫气体全部排出。E中二氧化硫与氢氧化钠反应产生亚硫酸钠和水的化学方程式为:SO2+2NaOH=Na2SO3+H2O。
(2)铜与浓硫酸反应,符合质量守恒定律,反应前后各元素的原子个数不变,反应物中含1个铜原子,4个氢原子、2个硫原子、8个氧原子,生成物中含1个铜原子、2个硫原子、6个氧原子,故还应含4个氢原子、2个氧原子,故化学方程式为:Cu+2H2SO4(浓))![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
反思交流
(1)根据以上探究,同学们设计了两种制取硫酸铜的实验方案:
小明认为方案②较好,你认为该方案较好的理由是:无污染,不会产生二氧化硫有毒气体,且节约H2SO4(或节约药品);
(2)下列各组药品能够证明铁的活动性比铜强的是:
①铁和硫酸铜溶液能发生置换反应产生铜,可以证明铁的活动性比铜强;故选项正确;
②铁能与稀硫酸反应,但铜不能,可以证明铁的活动性比铜强;故选项正确;
③铁、铜都不能与硫酸锌溶液反应,不能证明铁的活动性比铜强
故选:①②。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案