题目内容
【题目】飞机制造大量使用了金属、橡胶和复合材料。请根据所学知识和有关信息回答问题。
(1)飞机材料往往使用大量的铝合金而不使用纯铝,其原因是合金的硬度__(填大于或小于)纯金属的硬度。
(2)金属铜在飞机材料中也有应用。同时铜也容易形成钢锈Cu2(OH)2CO3,在加热的条件下,铜锈分解产生三种常见的氧化物且所有元素化合价不发生变化。根据描述,书写该反应的化学方程式: ____。
(3)现有三种金属铁、铝、铜,欲要验证其金属活动性强弱,下列方法不可行的是___(填序号)。
A Fe、Al、CuSO4溶液
B Fe、Al、Cu、H2SO4溶液
C Al、Cu、FeSO4溶液
D Fe、Al2(SO4)3溶液、CuSO4溶液
【答案】大于 ![]() A
A
【解析】
(1)飞机材料往往使用大量的铝合金而不使用纯铝,其原因是合金的硬度大于纯金属的硬度。
(2)金属铜在飞机材料中也有应用。同时铜也容易形成铜锈Cu2(OH)2CO3,在加热的条件下,铜锈分解产生三种常见的氧化物且所有元素化合价不发生变化,说明碱式碳酸铜受热分解生成氧化铜、水和二氧化碳,该反应的化学方程式:Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑。
2CuO+H2O+CO2↑。
(3)A.Fe、Al分别伸入CuSO4溶液,表面都析出红色固体,说明铜最不活泼,不能比较铁和铝的活泼性;
B.Fe、Al、Cu分别伸入H2SO4溶液,铝表面产生气泡速率比铁表面产生气泡速率快,说明铝比铁活泼,铜表面无明显现象,说明铜不如铁、铝活泼;
C.Al、Cu分别伸入FeSO4溶液,铝表面析出黑色固体,是因为铝和硫酸亚铁反应生成硫酸铝和铁,说明铝比铁活泼,铜表面无明显现象,说明铁比铜活泼;
D.Fe分别伸入Al2(SO4)3溶液、CuSO4溶液,伸入硫酸铝溶液中无明显现象,说明铝比铁活泼,伸入硫酸铜溶液中铁表面析出红色固体,说明铁比铜活泼;
由以上分析可知,A实验不可行。
故填:(1)大于;(2)Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑;(3)A。
2CuO+H2O+CO2↑;(3)A。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】学习氢氧化钠的化学性质后,小明做了如下实验,请你补充完整:(提示:氯化镁溶液为无色,不能使酚酞溶液变红)
实验 | 实验操作 | 实验现象 | 结论或解释 |
(1) |
| 现象为________ | 二氧化碳与氢氧化钠发生化学反应 |
(2) |
| 溶液由无色变为红色 | 结论为________ |
(3) |
| 加人稀盐酸后,未观察到明显现象;滴人酚酞后,溶液变红色 | 盐酸与氢氧化钠未发生化学反应 |
(4) |
| 有白色沉淀生成 | 生成沉淀的原因(用化学方程式解释)_______ |
(5)小军认为小明实验(1)操作设计不足以说明二氧化碳与氢氧化钠发生化学反应,应做的改进是________;小军还认为小明实验(3)的结论不正确。
(6)将(2)(3)(4)实验后试管中的物质倒人一个洁净的烧杯中,烧杯中有白色沉淀,静置,上层清液无色,据此可知上层清液中溶质的成分一定有(除指示剂外)________,为了检验可能存在的溶质,你的实验方案是________。
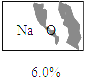
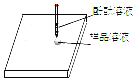
【题目】某化学兴趣小组的同学在整理化学药品柜时,发现有一瓶标签受损的无色溶液(受损标签如图所示)。咨询实验老师得知,这瓶无色溶液是一种常用的盐溶液。小组同学对这瓶溶液进行了如下探究:
(提出问题)这瓶无色溶液是什么物质的溶液?
(猜想与假设)小组同学提出了如下假设:
①碳酸钠溶液;②硫酸钠溶液;③氯化钠溶液
(讨论交流)在老师的指导下,小组同学经过讨论,认为有一条假设不合理。
(1)请你指出不合理的假设并说明不合理的理由_____。
(查阅资料)硫酸钡既不溶解于水又不溶解于酸;碳酸钠溶液呈碱性;Ba(OH)2 的化学性质与 Ca(OH)2相似。
(进行实验)小组同学设计并进行了如下实验,请你完善小组同学的“相互评价”。
组次 | 实验操作 | 出现的现象与结论 | 同学相互评价 |
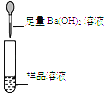
第 1 组 |
| 产生白色沉淀,第 1 组同学认为猜想②成立 | 第 2 组同学认为此方案结论不正确。 (2)你认为其理由是硫酸钡和_____都不溶于水。 |
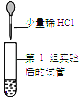
第 2 组 |
| 试管中无明显现象,第2 组同学认为猜想 ②成立。 | 第3组同学认为此方案结论不正确。 (3)你认为其理由是_____。 |
第 3 组 |
| 溶液无明显变化,第 3 组同学认为猜想②成立。 | 第 1 组同学认为此方案结论正确。 (4)你认为实验中用点滴板比试管具有更多的优点是_____ (写 1 条即可)。 |
(实验反思)针对上述情况,小组同学总结了取用药品时的各种注意事项。
(5)你认为倾倒液体药品时,要注意标签_____。