题目内容
硫酸和盐酸既是实验室常用的试剂,也是重要的化工原料。写出用稀硫酸除去铁锈的化学方程式: ; 打开盛有浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是因为: ;将20g质量分数为98%的浓硫酸稀释为10%的硫酸,需要水的质量为 g。
Fe2O3 + 3H2SO4 ="==" Fe2 (SO4) 3+ 3H2O;浓盐酸有挥发性,瓶口有白雾的是浓盐
酸;176
解析试题分析:工业上常用稀盐酸和稀硫酸来除铁锈,稀硫酸除去铁锈的化学方程式为Fe2O3 + 3H2SO4 ="==" Fe2 (SO4) 3+ 3H2O,打开盛有浓盐酸的试剂瓶,浓盐酸的瓶口会产生白雾,而浓硫酸的瓶口无明显现象,将20g质量分数为98%的浓硫酸稀释为10%的硫酸,根据稀释前后溶质的质量不发生改变,可以算得需要水的质量为176g。
考点:稀硫酸除铁绣,浓硫酸的稀释

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
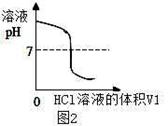
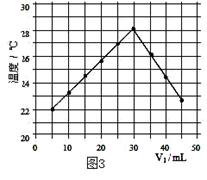
将V1mL3.65% HCl溶液逐滴滴入盛有V2mL未知浓度的
NaOH溶液的烧杯中(图1),测量并记录溶液的pH变化(图2)和
温度变化(图3)。(实验中始终保持 V1+V2=50.0mL且各种溶液密度
均为1.0g/mL)。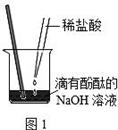
(1)图2中V1="0" mL时,图1中烧杯内溶液的颜色显 色;
(2)实验中发生反应的化学方程式为 ;
(3)图2中的pH=7时,此时滴入的HCl溶液的体积V1= mL;
(4)通过该实验给出的判断,其中正确的是 ;
| A.进行该实验时环境温度为22℃ |
| B.该实验表明化学能可转化为热能 |
| C.该实验表明有水生成的反应都是放热反应 |
| D.溶液由碱性转变为中性,再转变为酸性且酸性不断减弱 |
可用于治疗胃酸过多的物质是
| A.NaCl | B.CaO | C.Al(OH)3 | D.NaOH |
 Na2CO3+ H2O + CO2↑。其中,NaHCO3属于 (“酸”、“碱”或“盐”),反应②属于 反应,Na2CO3的俗名叫 。
Na2CO3+ H2O + CO2↑。其中,NaHCO3属于 (“酸”、“碱”或“盐”),反应②属于 反应,Na2CO3的俗名叫 。