题目内容
如图是配制100g质量分数为10%的氢氧化钠溶液的实验操作示意图,下列相关叙述中正确的是
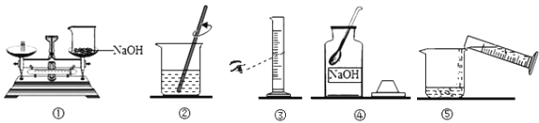
A. 图中的错误操作只有③
B. 配制好的氢氧化钠溶液不需要密封保存
C. 图中配制溶液的正确操作顺序可以是④①③⑤②
D. 按图中操作量取所需要的水,会导致所配溶液的溶质质量分数大于10%
练习册系列答案
相关题目
实验是学习化学中的重要手段,以下实验方法和操作中不能达到实验目的的是
选项 | 实验目的 | 实验方法和操作 |
A | 鉴别O2和CO2 | 分别伸入燃着的木条 |
B | 鉴别NaOH、NaCl | 取样于表面皿中,观察固体是否潮解 |
C | 除去NaCl溶液中混有的CaCl2 | 加适量K2CO3溶液、过滤 |
D | 除去FeSO4溶液中的CuSO4 | 加足量Fe粉,过滤 |
A. A B. B C. C D. D






