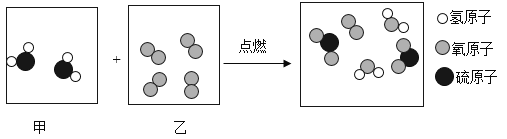
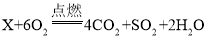题目内容
【题目】同学们运用对比的学习方法探究碱的性质.
实验一 | 实验二 | 实验三 |
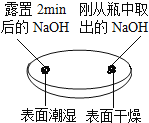
观察固体表面
| 向两块固体表面滴加稀盐酸
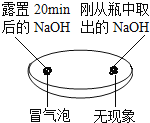
| 振荡三个塑料瓶
|
(1)由如图实验一、二可知,氢氧化钠会吸收空气的________,因此要密封保存.
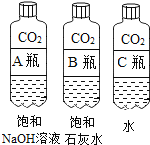
(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C,A瓶内发生反应的化学方程式为________,对比A瓶与________(选填“B”或“C”)瓶的实验现象可证明CO2能与NaOH发生反应.
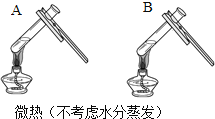
(3)同学们设计如下两种方案鉴别氢氧化钠溶液与氢氧化钙溶液(分别编号为A、B).
方案一 | 方案二 | 分析 |
|
| 两种方案中均观察到A试管内出现白色浑浊,A中试剂为________;方案二的A溶液变浑浊的原因是________. |
(4)同学们看到盛有NaOH的试剂瓶上标注着“NaOH含量不少于96.0%”,开始如下探究:
(提出问题)氢氧化钠中含有什么杂质?
(查阅资料)①在化工生产中,原料往往不能全部转化为产品.
②工业制取NaOH的反应原理是:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体.
2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体.
③碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应.
(提出猜想)氢氧化钠中含有的杂质为碳酸钠和氯化钠.提出上述猜想的理由是________.
(实验探究)取样溶于水,并分成两份.
步骤I:向一份溶液中滴加酚酞试剂;
步骤II:向另一份溶液中滴加过量稀盐酸;
(实验结论)两份溶液中均有明显现象,证明杂质中一定含有碳酸钠.
(反思评价)上述实验中步骤________(填写序号)是没有必要进行的.
【答案】水、二氧化碳(或H2O、CO2) ![]() C 氢氧化钙溶液 温度升高氢氧化钙的溶解度减小,氢氧化钙析出 可能有氯化钠没有全部反应,又因为氢氧化钠与空气中的二氧化碳反应生成碳酸钠 步骤I
C 氢氧化钙溶液 温度升高氢氧化钙的溶解度减小,氢氧化钙析出 可能有氯化钠没有全部反应,又因为氢氧化钠与空气中的二氧化碳反应生成碳酸钠 步骤I
【解析】
(1)由上图实验一、二可知,氢氧化钠会吸收空气的水、二氧化碳(或H2O、CO2),因此要密封保存;
(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C,A瓶内发生反应为二氧化碳与氢氧化钠溶液反应,则其化学方程式为![]() ,二氧化碳能溶于水且与水反应生成碳酸,使瓶内压强减小,塑料瓶变瘪,A瓶比C瓶变瘪的程度大,故对比A瓶与 C瓶的实验现象可证明CO2能与NaOH发生反应.
,二氧化碳能溶于水且与水反应生成碳酸,使瓶内压强减小,塑料瓶变瘪,A瓶比C瓶变瘪的程度大,故对比A瓶与 C瓶的实验现象可证明CO2能与NaOH发生反应.
(3)方案一:碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,氢氧化钠与碳酸钠不反应,方案二:加热后,A中出现白色浑浊,氢氧化钙的溶解度随温度的升高而减小,氢氧化钠的溶解度随温度升高而增大,A中出现浑浊,说明A是氢氧化钙,温度升高,溶解度减小,故A中试剂为氢氧化钙溶液;方案二的设计原理是利用了 氢氧化钙的溶解度随温度升高而减少;氢氧化钠的溶解度随温度升高而升高;两者的溶解度受温度影响情况不同.
(4)提出猜想:
根据工业制取NaOH的反应原理是:![]() ,然后蒸发溶剂获得NaOH固体;可能有氯化钠没有全部反应,又因为氢氧化钠与空气中的二氧化碳反应生成碳酸钠;
,然后蒸发溶剂获得NaOH固体;可能有氯化钠没有全部反应,又因为氢氧化钠与空气中的二氧化碳反应生成碳酸钠;
反思评价:
①由于氢氧化钠溶液显碱性,滴加无色酚酞溶液一定会变红色,无法做出判断;上述实验中步骤I是没有必要进行的。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】某学校实验开放日,化学兴趣小组进行了以下实验探究。
实验探究一:
I.探究酸和碱能否发生反应
方案1:甲同学向盛有少量NaOH溶液的试管中滴几滴无色酚酞试液,振荡,继续加入稀硫酸,观察到(__________)现象时才能得出酸和碱能发生反应的结论。
方案2:乙同学取少量NaOH溶液,测得溶液pH为10,向该溶液中加入一定量稀硫酸后,测得溶液pH为9,乙同学发现溶液pH减小了,得出结论:酸和碱能发生反应。
交流讨论:大家同意甲同学的结论,对乙同学的实验过程提出质疑,溶液pH减小的原因还可能是稀硫酸中的水稀释了NaOH溶液:大家认为,乙同学向NaOH溶液中加入稀硫酸后,测得溶液的pH必须(__________)才能证明酸和碱能发生反应。
Ⅱ.探究酸和碱反应后溶液中溶质的成分丙同学对探究![]() 中甲同学实验后的无色溶液展开探究。
中甲同学实验后的无色溶液展开探究。
(提出问题)试管中无色溶液的溶质除了酚酞还有什么?
(进行猜想)(l)Na2SO4;(2)Na2SO4和H2SO4;(3)Na2SO4和NaOH
同学们对猜想(3)提出了疑问,原因是![]() ____
____![]()
(设计实验)
实验操作 | 实验现象 | |
方案1 | 向试管中加入少量锌粒,然后加入甲同学实验后的无色溶液 | 锌粒逐渐减少,有产生气泡 |
方案2 | 向试管中加入少量甲同学实验后的无色溶液,然后慢慢滴加NaOH溶液,并不断振荡试管 | 开始无明显现象,过一会发现 |
实验探究二:如图1

确定未知溶液A是稀盐酸还是稀硫酸。
实验如下:
(提出问题)A是哪一种酸?老师要求甲、乙同学从反应后的溶液B分别展开探究。
(猜想假设)甲同学:A是稀盐酸:乙同学:![]() 是稀硫酸
是稀硫酸
(实验探究)如图2
(评价交流)
下列对于甲、乙两同学的实验分析正确的是(__________)
A.甲同学的实验方案和结论正确:实验3所得溶液中可能含有H+、NO3-、C1-、Na+
B.甲同学的实验方案和结论正确:实验3所得溶液中一定含有H+、NO3-、C1-、Na+
C.乙同学的实验方案和结论正确:实验3所得溶液中可能含有H+、NO3-、C1-、Na+
D.乙同学的实验方案和结论正确:实验3所得溶液中一定含有H+、NO3-、C1-、Na+
(归纳总结)
对比甲、乙两位同学的实验,我们能够总结出。除去溶液中干扰离子的一般方法是:选择试剂将干扰离子变成________除去。
【题目】对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
实验内容 | 实验现象 | 分析与结论 |
| 醋酸晶体试管内___,醋酸溶液试管中镁带表面冒气泡。 | 酸的很多反应通常在水溶液中才能完成。 |
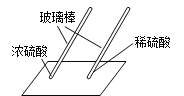
用玻璃棒蘸硫酸在白纸上写字 | _______(填“浓”或“稀”)硫酸使白纸炭化。 | 即使是同种酸,由于____不同,它们的性质不完全相同。 |
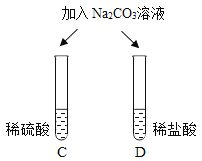
| 两试管中均产生_____ | 不同的酸具有相似的性质,这是因为酸的组成中都含有_____(填元素符号)。 |
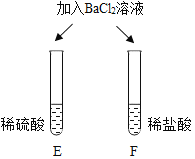
| E试管中产生_____, F试管中无明显现象。 | 不同的酸根会导致酸的“个性”差异。因此,可用氯化钡溶液鉴别盐酸和硫酸。 |
清洗试管时,小乔同学将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请分析上述现象并回答:
Ⅰ.废液缸中产生气体的化学方程式为______。
Ⅱ. 废液缸里最终产生的白色沉淀中一定有硫酸钡,可能有____(填化学式)。
【题目】古“丝绸之路”促进了东西方经济的发展和文化的交流。
请从A和B两题中任选1个作答。
A | B |
瓷器出粘土,石英等矿物烧而成,矿物主要成分有二氧化硅(SiO2),硅酸铝[Al2(SiO3)3]等, (1)其中属于氧化物的是_____ (2)硅酸铝相对分子质量的计算式为_____ | (1)新鲜茶叶中的儿茶素(C15H14O6)具有抗肿瘤、氧化和保护心脑器官等作用。宏观上儿茶素由_____组成。 (2)海上丝编之路把宝石有带入中国。蓝宝石、红宝石的主要成分是Al2O3.铝元素的化合价是_____ |
【题目】高锰酸钾在生产、生活中有广泛的应用。实验小组同学查阅资料得知,草酸(H2C2O4)可使滴有硫酸的高锰酸钾溶液褪色,但不同条件下褪色时间不同,即反应的速率不同。小组同学进行了如下探究。
(提出问题)影响该反应反应速率的因素有哪些?
(作出猜想)影响该反应反应速率的因素有温度、催化剂、硫酸的浓度等。
(查阅资料)硫酸锰(MnSO4)可作该反应的催化剂。
(进行实验)取A、B、C、D 4支试管,每支试管中分别加入4mL 0.08% 的KMnO4 溶液、0.4 mL 的硫酸、1mL 0.09% 的 H2C2O4 溶液。

(实验记录)
序号 | 所滴硫酸浓度 | 温度 | 催化剂 | 高锰酸钾完全褪色时间 |
A | 98% | 室温 | 无 | 72s |
B | 65% | 室温 | 无 | 129s |
C | 65% | 50℃ | 无 | 16s |
D | 65% | 室温 | MnSO4 | 112s |
(解释与结论)
(1)草酸使高锰酸钾溶液褪色反应的化学方程式如下,请在横线上补全方程式。
2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10_______+ 8H2O
(2)4支试管中作为对照实验的是_______(填序号,下同)。
(3)设计实验A和B的目的是 ______________________________。
(4)对比实验B和C可得出的结论是_____________________________。
(5)探究催化剂对该反应反应速率影响的实验是____________________________。
(反思与交流)
(6)影响该反应反应速率的因素除温度、催化剂、硫酸的浓度外,还可能有_______。