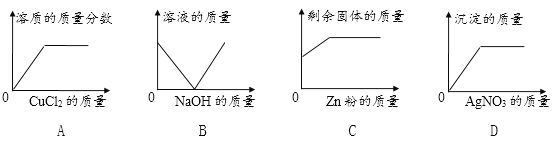
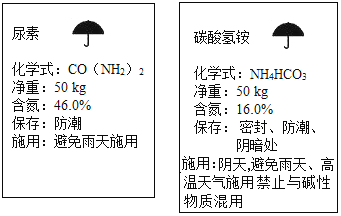
题目内容
【题目】化学基础与常识
(1)生活中安装门窗经常用到铝合金。铝合金与纯铝比较,优点在于_______________________。
(2)若不小心被蚊虫叮咬(蚊虫能分泌出蚁酸),可用下列物质之一涂抹以减轻疼痛,该物质是___________ (填序号)。
A 食醋(pH=37) B 食盐水(pH=7) C 石灰水(pH=10.5) D 肥皂水(pH=7.8)
(3)煤油中含有噻吩(用Ⅹ表示),噻吩具有令人不愉快的气味,其燃烧时发生反应的化学方程式表示为: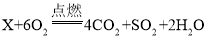 ,则噻吩的化学式为________。
,则噻吩的化学式为________。
(4)如图是某反应的微观示意图。
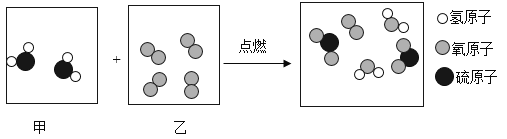
其反应化学方程式为__________________。
(5)要证明某无色溶液显酸性,下列试剂可行的是_______________(多选,填序号)。
A 紫色石蕊溶液 B 无色酚酞溶液 C 金属铜 D 碳酸钠溶液 E 氢氧化钠溶液
【答案】硬度大 D C4H4S 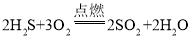 AD
AD
【解析】
(1)铝合金属于铝的合金,合金比组成它的纯金属的硬度大、耐腐蚀等;
(2)蚁酸显酸性,可涂抹碱性物质,中和反应,减轻疼痛。
A、食醋显酸性,不符合题意;
B、食盐水显中性,不符合题意;
C、石灰水显碱性,但是碱性较强,不能涂抹,不符合题意;
D、肥皂水显碱性,符合题意。
故选D;
(3)根据质量守恒定律,化学反应前后,原子的种类和数目不变,结合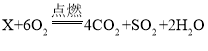 ,反应物中含12个氧原子,生成物中含4个碳原子、1个硫原子、4个氢原子,12个氧原子,故反应物中还应含4个碳原子、1个硫原子、4个氢原子,故X的化学式为:C4H4S;
,反应物中含12个氧原子,生成物中含4个碳原子、1个硫原子、4个氢原子,12个氧原子,故反应物中还应含4个碳原子、1个硫原子、4个氢原子,故X的化学式为:C4H4S;
(4)由图可知,该反应是硫化氢在氧气中燃烧生成二氧化硫和水,该反应的化学方程式为: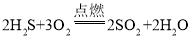 ;
;
(5)A、紫色石蕊试液遇酸变红,可用紫色石蕊试液鉴别,符合题意;
B、无色酚酞溶液在中性和酸性溶液中都不变色,故不能用无色酚酞试液鉴别,不符合题意;
C、在金属活动性顺序里,铜位于氢之后,铜与酸不反应,无明显现象,不能用铜鉴别,不符合题意;
D、碳酸钠能与酸反应生成二氧化碳气体,有气泡产生,可以鉴别,符合题意;
E、氢氧化钠与酸反应无明显现象,不能用氢氧化钠来鉴别,不符合题意。
故选AD。

【题目】学校在进行消防演练过程中,老师带领学生使用干粉灭火器进行模拟灭火演练。化学兴趣小组收集灭火后残留的白色固体,探究其成分(不考虑杂质的影响)。

[查阅资料]
①干粉灭火器的主要成分是碳酸氢钠。
②碳酸氢钠受热分解 生成碳酸钠、水和二氧化碳;碳酸钠受热难分解。
③碳酸氢钠与氯化钙不发生反应。.
[提出猜想]
猜想--:固体成分为碳酸钠;
猜想二:固体成分为碳酸氢钠;
猜想三:固体成分为________________。
[实验验证]
步骤 | 现象 | 结论 |
小明同学取少是白色固体于试管中,加水溶解,再滴入无色酚酞溶液 | 无色酚酞溶液变红 | 猜想一成立 |
[提出质疑]
小红认为小明得出的结论不准确。小红知道碳酸氢钠在医疗上是治疗胃酸过多症的一种药剂,推测碳酸氢钠的水溶液可能显_______性,并通过实验得到了验证。
[实验探究]小明和小红继续实验:
步骤 | 现象 | 结论 |
1.取少量白色固体加热,将生成的气体通入澄清石灰水中。 | 澄清石灰水变浑浊 | 固体中含有碳酸氢钠,写出石灰水变浑浊的化学方程式:__________________ |
2.另取少量的白色固体加水溶解,向所得溶液中滴入氯化钙溶液。 | _____________ | 总结论:猜想三成立 |
[拓展延伸]
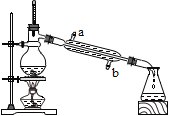
师生通过讨论又设计了另-种实验方案(如下图):关闭弹簧夹,将注射器内等体积、等质量分数的稀盐酸同时加入试管中,观察到甲、乙丙的三支试管中均有气泡产生。
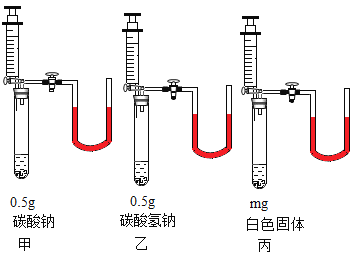
(1)丙试管中的m的数值为______g;
(2)0.5g碳酸钠与5%的稀盐酸完全反应,生成二氧化碳的质量为____ g. (结果精确到0.1)
(3)关闭注射器活塞,打开弹簧夹,待反应结束后(固体完全消失),打开弹簧夹,U型管两侧液面变化是:___________,U型管右侧液面变化大小比较是:______,进一步证明猜想三成立。
【题目】同学们运用对比的学习方法探究碱的性质.
实验一 | 实验二 | 实验三 |
观察固体表面
| 向两块固体表面滴加稀盐酸
| 振荡三个塑料瓶
|
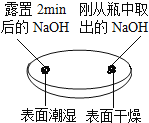
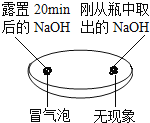
(1)由如图实验一、二可知,氢氧化钠会吸收空气的________,因此要密封保存.
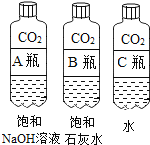
(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C,A瓶内发生反应的化学方程式为________,对比A瓶与________(选填“B”或“C”)瓶的实验现象可证明CO2能与NaOH发生反应.
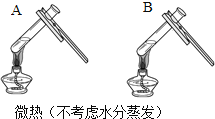
(3)同学们设计如下两种方案鉴别氢氧化钠溶液与氢氧化钙溶液(分别编号为A、B).
方案一 | 方案二 | 分析 |
|
| 两种方案中均观察到A试管内出现白色浑浊,A中试剂为________;方案二的A溶液变浑浊的原因是________. |
(4)同学们看到盛有NaOH的试剂瓶上标注着“NaOH含量不少于96.0%”,开始如下探究:
(提出问题)氢氧化钠中含有什么杂质?
(查阅资料)①在化工生产中,原料往往不能全部转化为产品.
②工业制取NaOH的反应原理是:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体.
2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体.
③碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应.
(提出猜想)氢氧化钠中含有的杂质为碳酸钠和氯化钠.提出上述猜想的理由是________.
(实验探究)取样溶于水,并分成两份.
步骤I:向一份溶液中滴加酚酞试剂;
步骤II:向另一份溶液中滴加过量稀盐酸;
(实验结论)两份溶液中均有明显现象,证明杂质中一定含有碳酸钠.
(反思评价)上述实验中步骤________(填写序号)是没有必要进行的.