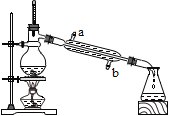
��Ŀ����
����Ŀ�����ǽӴ�������Щ��ѧ��Ӧ������������ġ���ͼ����ʵ�鶼��ͨ���μ������Լ��ķ�����ʹ֮�������Ե�������֤����Ӧȷʵ�����ˡ���ش��������⣺

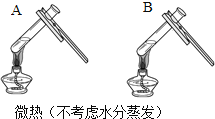
��1��ʵ�������֤����Ӧ��������������Һ��________ɫ��Ϊ��ɫ����ʱ��Һ��һ�������е�������__________��
��2��ʵ������Ҫ֤����Ӧ��ȷ�����ˣ�Ӧѡ�õ����ָʾ����______________��
��3���ܵ��ס���ʵ�������������ͬѧ��Ϊʵ����е��Լ�Ҳ����ѡ����ɫ��̪��Һ����ͬѧ�����ϱ�ʾ���ԣ�������___________________________________��С��ͬѧ��ѡ�ü�Ӧ�����Һ������Թ��У��۲쵽�������ݲ��������а�ɫ�������ɡ��ɴ˼�֤��������������Һ���������̼��Ӧ�����ƶϳ����Թܷ�Ӧ����Һ�к��е�������____________����ָʾ���⣩����д�����Թ������ɰ�ɫ�����Ļ�ѧ����ʽ________________________��
���𰸡��� Ca(OH)2 ��ɫʯ����Һ ̼������ҺҲ�Լ��� HCl��CaCl2 CaCl2+Na2CO3=CaCO3��+2NaCl
��������
��1����������Ϊ������Һ����ʹ��̪��Һ��죬����̪���������Ի�������Һʱ��Ϊ��ɫ����˵���Һ�ɺ�ɫ�����ɫʱ����֤�����������ƺ�ϡ���ᷢ���˷�Ӧ����ҺΪ��ɫ֤�����治�����м������ʣ����Է�Ӧ�����Һ��һ�������е��������������ƣ�����죻Ca(OH)2��
��2��ˮ�Ͷ�����̼��Ӧ����̼�ᣬ̼����ʹ��ɫʯ����Һ���ɫ������ʵ������ѡ�õ����ָʾ������ɫʯ����Һ�������ɫʯ����Һ��
��3������������Һ�Լ�����ʹ��ɫ��̪��죬����Ӧ���ɵ�̼����Ҳ�Լ��ԣ�Ҳ��ʹ��ɫ��̪��죬��˼�����ɫ��̪�ܷ�����Ӧ���Ǻ�ɫ����֤�����Ƿ����˷�Ӧ���ü�Ӧ�����Һ������Թ��У��۲쵽�������ݲ�����˵�����к���ϡ���ᣬϡ�����̼���Ʒ�Ӧ���ɶ�����̼�ŵ��¿����������ݲ��������а�ɫ�������ɣ�˵�����л������������ƺ�ϡ���ᷴӦ���ɵ��Ȼ��ƣ��Ȼ��ƺ�̼���Ʒ�Ӧ������̼��Ƶİ�ɫ��������Ӧ�ǻ�ѧ����ʽΪ��CaCl2+Na2CO3=CaCO3��+2NaCl�����̼������ҺҲ�Լ��ԣ�HCl��CaCl2��CaCl2+Na2CO3=CaCO3��+2NaCl��

 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�����Ŀ��ͬѧ�����öԱȵ�ѧϰ����̽��������ʣ�
ʵ��һ | ʵ��� | ʵ���� |
�۲�������
| ������������μ�ϡ����
| ����������ƿ
|
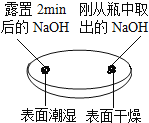
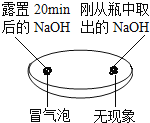
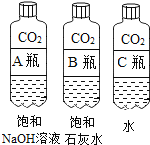
(1)����ͼʵ��һ������֪���������ƻ����տ�����________�����Ҫ�ܷⱣ�森
(2)ʵ�����пɹ۲쵽����������ƿ���ij̶ȴ�СΪA>B>C��Aƿ�ڷ�����Ӧ�Ļ�ѧ����ʽΪ________���Ա�Aƿ��________(ѡ�B����C��)ƿ��ʵ�������֤��CO2����NaOH������Ӧ��
(3)ͬѧ������������ַ�����������������Һ������������Һ(�ֱ���ΪA��B)��
����һ | ������ | ���� |
|
| ���ַ����о��۲쵽A�Թ��ڳ��ְ�ɫ���ǣ�A���Լ�Ϊ________����������A��Һ����ǵ�ԭ����________�� |
(4)ͬѧ�ǿ���ʢ��NaOH���Լ�ƿ�ϱ�ע�š�NaOH����������96.0%������ʼ����̽����
��������⣩���������к���ʲô���ʣ�
���������ϣ����ڻ��������У�ԭ����������ȫ��ת��Ϊ��Ʒ��
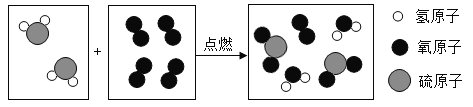
�ڹ�ҵ��ȡNaOH�ķ�Ӧԭ���ǣ�2NaCl+2H2O![]() 2NaOH+H2��+Cl2����Ȼ�������ܼ����NaOH���壮
2NaOH+H2��+Cl2����Ȼ�������ܼ����NaOH���壮
�ۼ��Ե�Na2CO3��Һ�����Ե�CaCl2��Һ�������ֽⷴӦ��
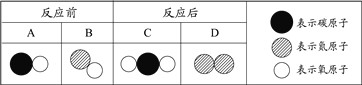
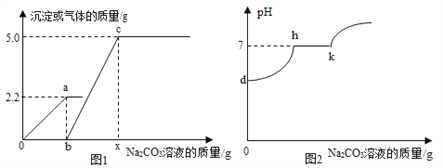
��������룩���������к��е�����Ϊ̼���ƺ��Ȼ��ƣ�������������������________��
��ʵ��̽����ȡ������ˮ�����ֳ����ݣ�
����I����һ����Һ�еμӷ�̪�Լ���
����II������һ����Һ�еμӹ���ϡ���
��ʵ����ۣ�������Һ�о�����������֤��������һ������̼���ƣ�
����˼���ۣ�����ʵ���в���________(��д���)��û�б�Ҫ���еģ�