题目内容
(1)海水中含有的颜色、异味可以用 除去.
(2)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、过滤、 可制得精盐.上述过程所用的主要玻璃仪器有:a烧杯、b玻璃棒、c 、d .
(3)晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,如图1是它们的溶解度曲线示意图.设t1℃时MgCl2、KCl和MgSO4三种物质的溶解度分别为a、b、c,则它们的大小关系为 .
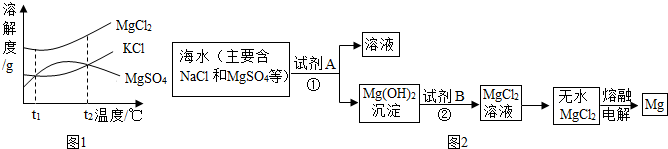
(4)目前世界上60%的镁是从海水中提取的.其主要步骤如图2:
①提取Mg的过程中,加入试剂A发生反应化学方程式为 ,加入试剂B发生反应化学方程式为 ,
②分离出Mg(OH)2后的NaCl溶液中还含有杂质CaCl2、Na2SO4,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液和Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了除去 ;加入过量Na2CO3溶液的目的是 .
(2)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、过滤、
(3)晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,如图1是它们的溶解度曲线示意图.设t1℃时MgCl2、KCl和MgSO4三种物质的溶解度分别为a、b、c,则它们的大小关系为

(4)目前世界上60%的镁是从海水中提取的.其主要步骤如图2:
①提取Mg的过程中,加入试剂A发生反应化学方程式为
②分离出Mg(OH)2后的NaCl溶液中还含有杂质CaCl2、Na2SO4,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液和Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了除去
考点:对海洋资源的合理开发与利用,固体溶解度曲线及其作用,氯化钠与粗盐提纯,盐的化学性质,碳单质的物理性质及用途,书写化学方程式、文字表达式、电离方程式
专题:常见的盐 化学肥料
分析:(1)根据活性炭具有吸附性解答;
(2)粗盐经过溶解、过滤、蒸发可得到精盐;所用的主要玻璃仪器有:烧杯、玻璃棒、漏斗、酒精灯;
(3)由MgCl2、KCl和MgSO4溶解度曲线示意图可知t1℃时MgCl2、KCl和MgSO4三种物质的溶解度大小;
(4)①提取Mg的过程中,加入试剂A为氢氧化钙,与氯化镁生成了氢氧化镁沉淀和硫酸钙;加入试剂B为稀盐酸,与氢氧化镁反应生成了氯化镁和水;
②实验中加入过量BaCl2溶液是为了除去SO42-;加入过量Na2CO3溶液的目的是除尽Ca2+、Ba2+.
(2)粗盐经过溶解、过滤、蒸发可得到精盐;所用的主要玻璃仪器有:烧杯、玻璃棒、漏斗、酒精灯;
(3)由MgCl2、KCl和MgSO4溶解度曲线示意图可知t1℃时MgCl2、KCl和MgSO4三种物质的溶解度大小;
(4)①提取Mg的过程中,加入试剂A为氢氧化钙,与氯化镁生成了氢氧化镁沉淀和硫酸钙;加入试剂B为稀盐酸,与氢氧化镁反应生成了氯化镁和水;
②实验中加入过量BaCl2溶液是为了除去SO42-;加入过量Na2CO3溶液的目的是除尽Ca2+、Ba2+.
解答:解:(1)根据活性炭具有吸附性,海水中含有的颜色、异味可以用活性炭除去;
(2)粗盐经过溶解、过滤、蒸发可得到精盐;所用的主要玻璃仪器有:烧杯、玻璃棒、漏斗、酒精灯;
(3)由MgCl2、KCl和MgSO4溶解度曲线示意图可知t1℃时MgCl2、KCl和MgSO4三种物质的溶解度氯化镁最大,氯化钾等于硫酸镁;
(4)①提取Mg的过程中,加入试剂A为氢氧化钙,与氯化镁生成了氢氧化镁沉淀和硫酸钙;加入试剂B为稀盐酸,与氢氧化镁反应生成了氯化镁和水;
②实验中加入过量BaCl2溶液是为了除去SO42-;加入过量Na2CO3溶液的目的是除尽Ca2+、Ba2+.
答案:(1)活性炭;
(2)蒸发;酒精灯、漏斗;
(3)a>b=c;
(4)①MgSO4+Ca(OH)2=CaSO4+Mg(OH)2↓;Mg(OH)2+2HCl=MgCl2+2H2O;
②SO42-; 除尽Ca2+、Ba2+.
(2)粗盐经过溶解、过滤、蒸发可得到精盐;所用的主要玻璃仪器有:烧杯、玻璃棒、漏斗、酒精灯;
(3)由MgCl2、KCl和MgSO4溶解度曲线示意图可知t1℃时MgCl2、KCl和MgSO4三种物质的溶解度氯化镁最大,氯化钾等于硫酸镁;
(4)①提取Mg的过程中,加入试剂A为氢氧化钙,与氯化镁生成了氢氧化镁沉淀和硫酸钙;加入试剂B为稀盐酸,与氢氧化镁反应生成了氯化镁和水;
②实验中加入过量BaCl2溶液是为了除去SO42-;加入过量Na2CO3溶液的目的是除尽Ca2+、Ba2+.
答案:(1)活性炭;
(2)蒸发;酒精灯、漏斗;
(3)a>b=c;
(4)①MgSO4+Ca(OH)2=CaSO4+Mg(OH)2↓;Mg(OH)2+2HCl=MgCl2+2H2O;
②SO42-; 除尽Ca2+、Ba2+.
点评:本题考查了粗盐提纯和从海水中提取镁的反应原理,利用所学知识结合流程图信息是解答本题的关键,难度不大.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
生活中硬水和软水,用我们所学化学知识加以区别( )
| A、过滤 | B、蒸馏 |
| C、加肥皂水 | D、加木炭 |