题目内容
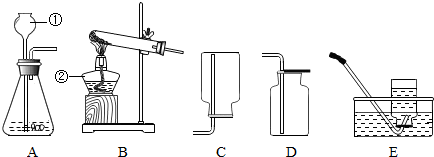
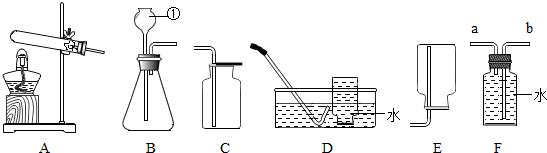
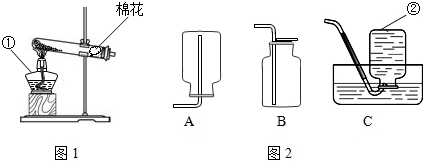
某课外小组设计了如图所示的实验装置,该装置既可用于制取气体,又可用于探究物质性质.
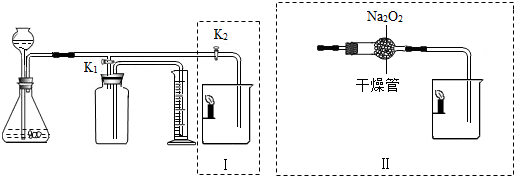
(1)当打开K1、关闭K2时,可完成用______(写反应物的名称)制取氧气的实验,其中量筒的作用是______.
(2)当打开K2、关闭K1时,可制得二氧化碳并验证其性质.实验室制取二氧化碳反应的化学方程式是______;可验证的二氧化碳的性质是______.
(3)在实验(2)中,若用II代替I,干燥管内反应的化学方程式是2Na2O2+2CO2=2X+Y,反应中若消耗39gNa2O2,生成Y的质量是8g,则X的化学式是______,II中烧杯内可观察到的现象是______.

(1)当打开K1、关闭K2时,可完成用______(写反应物的名称)制取氧气的实验,其中量筒的作用是______.
(2)当打开K2、关闭K1时,可制得二氧化碳并验证其性质.实验室制取二氧化碳反应的化学方程式是______;可验证的二氧化碳的性质是______.
(3)在实验(2)中,若用II代替I,干燥管内反应的化学方程式是2Na2O2+2CO2=2X+Y,反应中若消耗39gNa2O2,生成Y的质量是8g,则X的化学式是______,II中烧杯内可观察到的现象是______.
(1)如果用双氧水制氧气就不需要加热,制取氧气的实验中,其中量筒的作用是:测定收集的氧气的体积;故答案为:过氧化氢;测定收集的氧气的体积
(2)实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;本实验证明了二氧化碳既不能燃烧,也不能支持燃烧的性质;故答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O;不支持燃烧,本身也不燃烧
(3)根据化学方程式是2Na2O2+2CO2=2X+Y可知,2Na2O2生成一分子的Y,又因为39gNa2O2,生成Y的质量是8g,即156份Na2O2生成32份Y,因此Y是氧气,根据质量守恒定律可知:反应前后原子的种类和数目不变,因此X是碳酸钠;氧气具有氧化性和助燃性,因此蜡烛燃烧更旺;故答案为:Na2CO3;蜡烛燃烧更旺
(2)实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;本实验证明了二氧化碳既不能燃烧,也不能支持燃烧的性质;故答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O;不支持燃烧,本身也不燃烧
(3)根据化学方程式是2Na2O2+2CO2=2X+Y可知,2Na2O2生成一分子的Y,又因为39gNa2O2,生成Y的质量是8g,即156份Na2O2生成32份Y,因此Y是氧气,根据质量守恒定律可知:反应前后原子的种类和数目不变,因此X是碳酸钠;氧气具有氧化性和助燃性,因此蜡烛燃烧更旺;故答案为:Na2CO3;蜡烛燃烧更旺

练习册系列答案
相关题目