题目内容
现有下列装置,回答问题:

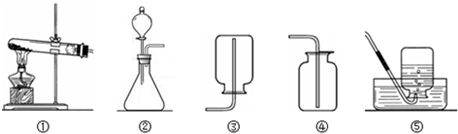
(1)写出有标号仪器的名称:①______②______③______;
(2)检查B装置的气密性的方法是:______,向长颈漏斗中加适量的水,若观察到长颈漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室若用A装置制取O2,则反应化学方程式为______;A装置中试管口塞一团棉花作用是______.收集氧气的装置可以选择______,理由是______,也可以选择______,理由是______.
(4)若实验室要制取CO2,则可选用上图中的______(填A-E)装置,收集装置可选______.
(2)检查装置B的气密性,可堵住右侧导管,向长颈漏斗中加适量的水,若观察到长颈漏斗末端出现稳定的水柱,则装置不漏气;
(3)A装置适合加热固体制取氧气,且试管口有棉花,说明是用高锰酸钾制取氧气,方程式是:2KMnO4
 K2MnO4+MnO2+O2↑;放棉花是为了防止加热时药品进入导管、堵塞导管;氧气的密度比空气大,可用向上排空气法收集,氧气不易溶于水,还可用排水法收集;
K2MnO4+MnO2+O2↑;放棉花是为了防止加热时药品进入导管、堵塞导管;氧气的密度比空气大,可用向上排空气法收集,氧气不易溶于水,还可用排水法收集;(4)在实验室中制取二氧化碳常用大理石或石灰石和稀盐酸反应来制取,属于固液常温型,所以应该选择B装置来制取二氧化碳气体;二氧化碳密度比空气大,能溶于水,所以应该选择C装置来收集二氧化碳;
故答案为:(1)铁架台;酒精灯;水槽;
(2)堵住右侧导管;
(3)2KMnO4
 K2MnO4+MnO2+O2↑;防止加热时高锰酸钾进入导管;C;氧气的密度比 空气大;E;氧气不易溶于水;
K2MnO4+MnO2+O2↑;防止加热时高锰酸钾进入导管;C;氧气的密度比 空气大;E;氧气不易溶于水;(4)B;C.
分析:(1)根据常见的化学仪器的名称进行分析解答;
(2)根据检查装置的气密性的方法分析解答;
(3)A装置适合加热固体制取氧气,且试管口有棉花,说明是用高锰酸钾制取氧气,据反应原理书写方程式;放棉花是为了防止加热时药品进入导管、堵塞导管;并据氧气的密度和溶解性选择收集装置;
(4)根据实验室中制取二氧化碳的反应原理和反应条件来选择反应的发生装置,根据二氧化碳的密度及水溶性来选择收集装置.
点评:本题主要考查了实验室制取气体发生装置、收集装置的选取和实验室制氧气的化学方程式,实验注意事项等,解题关键是要掌握选择装置的依据和要熟记一些常用的化学方程式.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案现有下列装置,回答问题:
 |
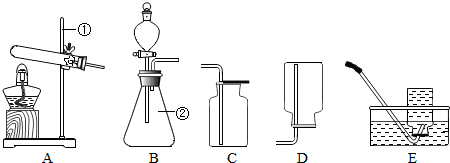
(1)写出有标号仪器的名称:① ▲ ;② ▲ ;
(2)检查B装置的气密性的方法是:堵住右侧导气管, ▲ ,向分液漏斗中加适量的水,若观察到漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室用H2O2溶液和MnO2制取O2的化学方程式为 ▲ 发生装置为 ▲ ,;
(4)实验室用KMnO4制取O2,选用的收集装置为 ▲ ;
(5)为进一步研究KMnO4的分解产物,某兴趣小组同学查阅资料,并取一定质量的KMnO4加热使之完全分解,同时进行了下表所示的实验。
| 编号 | 实验内容 | 实验现象 | 实验结论 |
| 1 | 取反应后固体剩余物0.2g加入5mL 6%的H2O2溶液中 | 剧烈反应,放出大量热量,产生大量气体 | 生成物中的MnO2催化分解H2O2 |
| 2 | 取0.2gMnO2加入5mL a (H2O2质量分数)的H2O2溶液中 | 平稳反应,发出热量,持续产生气体 | MnO2催化分解H2O2 |
| 3 | 取反应后固体剩余物1.0g加入足量水中,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | b |
【实验内容】:
【实验分析】:
①完善上表中的填空内容:a ▲ 、b ▲ ;
②实验2的目的是 ▲ ;
③经讨论,实验1的结论不正确,理由是 ▲ ;
 【资料】:Ⅰ、KMnO4受热分解时,会发生以下两个反应:
【资料】:Ⅰ、KMnO4受热分解时,会发生以下两个反应:
a、6KMnO4 2K2MnO4 + K2Mn4O8 + 4O2↑ b、KMnO4 KMnO2 + O2↑
Ⅱ、相对分子质量:(KMnO4:158 O2:32)
④取8.0gKMnO4,加热使之完全分解,生成O2的质量可能为 ▲ (2分)
A.0.81g B.1.08g C.1.42g D.1.62g
⑤资料显示,KMnO4在43.9℃~377.9℃范围中的失重率(O2与KMnO4质量比)为18.0% 。结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以 ▲ (填“a”或“b”)为主。