题目内容
现有下列装置,回答问题:
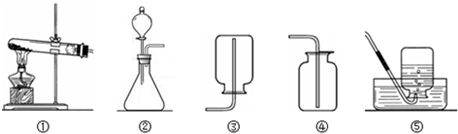
(1)能完成实验室制取二氧化碳气体的装置是______和______(填数字);
(2)实验室制取二氧化碳气体的化学方程式是______;
(3)能完成高锰酸钾制取氧气的装置是______和______(填数字),实验室用高锰酸钾制取氧气的化学方程式为______ K2MnO4+MnO2+O2↑
【答案】分析:本题考查的是二氧化碳和氧气的制取装置,同时也包含了氧气的验满方法.在常温下用石灰石和稀盐酸来制取二氧化碳,因此不需要加热.二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集.制取装置包括加热和不需加热两种,如果用过氧化氢和二氧化锰制氧气,就不需要加热;如果用高锰酸钾或氯酸钾就需要加热.氧气不易溶于水,密度比空气的密度大,因此可以用排水法和向上排空气法收集.
解答:解:(1)在常温下用石灰石和稀盐酸来制取二氧化碳,因此不需要加热.二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集.故答案为:②④
(2)碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平即可,故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑
(3)如果用高锰酸钾就需要加热.氧气不易溶于水,密度比空气的密度大,因此可以用排水法和向上排空气法收集.故答案为:①;④或⑤;2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(4)高锰酸钾中锰元素和氧元素的质量比是:55:64,如果高锰酸钾全部分解锰元素和氧元素的质量比是:55:64× =55:48,因此所得固体剩余物中Mn、O元素的质量比在55:64和55:48之间,都可以.故答案为:BC
=55:48,因此所得固体剩余物中Mn、O元素的质量比在55:64和55:48之间,都可以.故答案为:BC
点评:本考点主要考查气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关的计算,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.
解答:解:(1)在常温下用石灰石和稀盐酸来制取二氧化碳,因此不需要加热.二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集.故答案为:②④
(2)碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,配平即可,故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑
(3)如果用高锰酸钾就需要加热.氧气不易溶于水,密度比空气的密度大,因此可以用排水法和向上排空气法收集.故答案为:①;④或⑤;2KMnO4
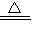 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑ (4)高锰酸钾中锰元素和氧元素的质量比是:55:64,如果高锰酸钾全部分解锰元素和氧元素的质量比是:55:64×
 =55:48,因此所得固体剩余物中Mn、O元素的质量比在55:64和55:48之间,都可以.故答案为:BC
=55:48,因此所得固体剩余物中Mn、O元素的质量比在55:64和55:48之间,都可以.故答案为:BC点评:本考点主要考查气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关的计算,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
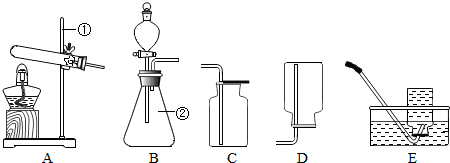
现有下列装置,回答问题:
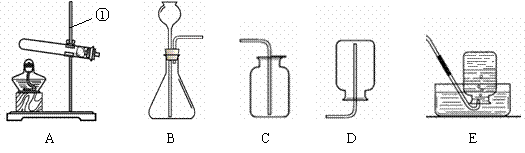 |
(1)写出有标号仪器的名称:① ▲ ;
(2)检查B装置的气密性的方法是: ▲ ,向长颈漏斗中加适量的水,若观察到长颈漏斗末端出现稳定的水柱,则装置不漏气;
(3)实验室制取H2的反应化学方程式为 ▲ ,发生装置为 ▲ ;
(4)实验发现:用40%的硫酸制取H2效果最好。现欲配制30mL 40%(密度为1.30g·mL—1)的硫酸,需要98%(密度为1.84g·mL—1)的浓硫酸 ▲ mL(精确到小数点后一位),需要水 ▲ mL(精确到小数点后一位)。量取浓硫酸时,若仰视读数(其他操作均正确),则所配硫酸的质量分数 ▲ 40%(填“>”或“=”或“<”),配制过程不需要的仪器是 ▲ ;
A.托盘天平 B.量筒 C.烧杯 D.玻璃棒 E.胶头滴管 F.铁架台
(5)实验室制取H2时,在硫酸溶液中滴入饱和CuSO4溶液会影响反应速率。右图是滴入饱和CuSO4溶液体积(X)与反应速率(Y)的关系图,请回答:
①滴入CuSO4溶液后,发生反应的化学方程式为 ▲ ;
②a点过后,反应速率降低的原因可能是 ▲ 。