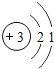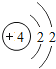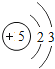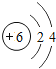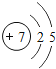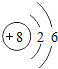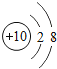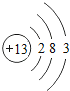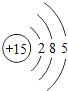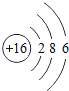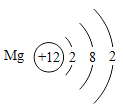��Ŀ����
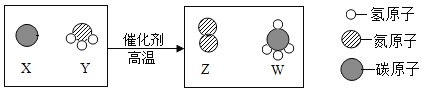
����Ŀ��ij����������ȼ��ȼ�ղ����ķ����е�SO2�ռ��������ȿ�������ϡ���ᣬ�����Ʊ��������䷴Ӧ������ͼ��ʾ��(������ԭ��������127)
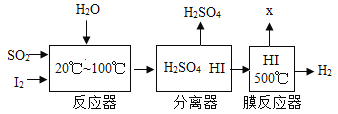
��1��д����Ӧ���з����Ļ�ѧ��Ӧ����ʽ_____________��
��2��Ĥ��Ӧ���з����Ļ�ѧ��Ӧ����__________��Ӧ(��д��ѧ��Ӧ��������)��
��3�����Ʊ������п�ѭ�����õ�������__________(����������)��
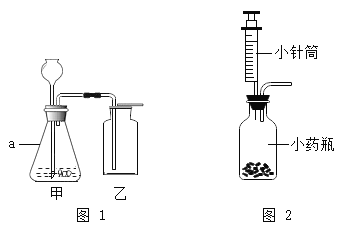
��4��������;�㷺������Ǧ�������к������ᣬ������Ҫ�õ�������������Ϊ24.5%��������Һ��
��ͬѧ����ʵ������Ũ��������ϡ���ᣬ���õ���ͷ�ιܡ���Ͳ���ձ��⣬����Ҫ�õ���������________��
��ʵ������98%��Ũ����(�ܶ�1.84g/mL)����24.5%��������Һ1200g����Ҫˮ������Ϊ______�ˣ���Ҫ98%Ũ��������Ϊ_______mL(������������0.1)��
���𰸡�![]() �ֽ� �� ������ 900 163.0
�ֽ� �� ������ 900 163.0
��������
��1������ͼ����Ϣ������֪����Ӧ���еķ�Ӧ��Ϊ���������ˮ��������������͵⻯�⣬���Ը÷�Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��
��2������ͼ����Ϣ������֪��Ĥ��Ӧ���еķ�Ӧ���ǵ⻯�⣬������һ�������������������غ㶨���ƶ���һ�������ǵ⣬���Ը÷�Ӧ�Ļ�ѧ����ʽΪ��![]() �����ڷֽⷴӦ��
�����ڷֽⷴӦ��
��3�������������̷�����֪����Ӧ�����õ⣬Ĥ��Ӧ�����ɵ⣬���Կ���ѭ�����õ������ǵ⣻
��4������Ũ��������ϡ���ᣬ�õ���ʵ�������н�ͷ�ιܡ���Ͳ���ձ�����������
��ʵ������98%��Ũ����(�ܶ�1.84g/mL)����24.5%��������Һ1200g������ҪŨ���������Ϊx����![]() ��
��![]() ����ΪҪ����1200g����Һ�����Ի���Ҫ��ˮ������=1200g-300g=900g������ΪŨ������ܶ���1.84g/mL��������ҪŨ��������
����ΪҪ����1200g����Һ�����Ի���Ҫ��ˮ������=1200g-300g=900g������ΪŨ������ܶ���1.84g/mL��������ҪŨ��������![]() ��
��

 ������ϰ�ο����뵥Ԫ���ϵ�д�
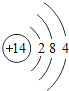
������ϰ�ο����뵥Ԫ���ϵ�д�����Ŀ���˵����Ϊ1��18��ԭ�ӽṹʾ��ͼ����Ϣ���£���ش��������⣺
��һ���� | 1H
| 2He
| |||||||
�ڶ����� | 3Li
| 4Be
| 5B
| 6C
| 7N
| 8O
| 9F
| 10Ne
| |
�������� | 11Na
| 12Mg
| 13Al
| 14Si
| 15P
| 16S
| 17Cl
| 18Ar
| |
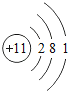
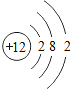
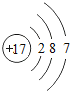
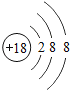
��1����ͬ��Ԫ����ʵ�������_____��ѡ����ţ�
A��������ͬ B������������ͬ C��������ͬ D���ԭ��������ͬ
��2���ڵ��������У���ԭ�ӽṹ�Ĺ�֮ͬ����_____���������У���ԭ�Ӻ�������Ų��ı仯������_____��
��3���ڵ��������У�Ԫ�����͵ı仯����ǣ���������_____Ԫ�ع��ɵ�_____Ԫ�أ�����ϡ������Ԫ�ؽ�β��
��4��д����������Ų�����ԭ����ͬ�������Ӻ������Ӹ�һ����������_____��������_____��