题目内容
 化学反应常伴随明显的现象,但有的反应也没有明显的现象.盐酸与氢氧化钠发生反应就没有明显现象.为证明该反应的发生,同学们展开了探究.
化学反应常伴随明显的现象,但有的反应也没有明显的现象.盐酸与氢氧化钠发生反应就没有明显现象.为证明该反应的发生,同学们展开了探究.【实验原理】反应的化学方程式为
【方案设计】
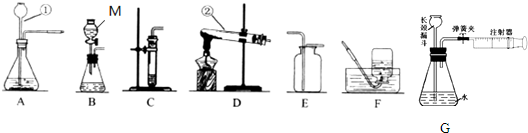
方案一:某同学借助酸碱中和会放出热量设计了如图所示的实验证明盐酸与氢氧化钠发生了反应,他应观察到红墨水向
方案二:请将你设计的另一种实验方案填入下表.
| 实验操作 | 实验现象 | 结论 |
| 盐酸与氢氧化钠 发生了化学反应 |
【实验拓展】氢氧化钠溶液与碳酸氢钠溶液的反应也无明显现象,为验证氢氧化钠与碳酸氢钠反应,同学们查阅资料如下:
Ⅰ.NaHCO3+NaOH=Na2CO3+H2O
Ⅱ.Ca(HCO3)2可溶,CaCO3难溶,Ca(OH)2微溶
然后他们进行实验.实验中,甲同学向NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液出现白色沉淀,接着用B试剂进行了相关实验,证明NaHCO3与NaOH发生了反应,实验中A、B试剂分别是
考点:中和反应及其应用,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见的酸 酸的通性
分析:【实验原理】稀盐酸和氢氧化钠反应生成氯化钠和水;
【方案设计】氢氧化钠和稀盐酸反应时放出热量,会导致锥形瓶中的气体膨胀,压强增大;
氢氧化钠溶液显碱性,能使酚酞试液变红色;
氯化钠溶液显中性,稀盐酸显酸性,都不能使酚酞试液变色;
【评价反思】氢氧化钠固体易溶于水,溶于水时能够放出大量的热;
【实验拓展】氯化钙能和碳酸钠反应生成碳酸钙白色沉淀和氯化钠;
氯化铵能和氢氧化钠反应生成氯化钠、水和氨气,氨气溶于水形成氨水,氨水能使红色石蕊试纸变蓝色;
澄清石灰水中含有氢氧化钙,氢氧化钙能和碳酸氢钠反应生成碳酸钙白色沉淀、氢氧化钠和水.
【方案设计】氢氧化钠和稀盐酸反应时放出热量,会导致锥形瓶中的气体膨胀,压强增大;
氢氧化钠溶液显碱性,能使酚酞试液变红色;
氯化钠溶液显中性,稀盐酸显酸性,都不能使酚酞试液变色;
【评价反思】氢氧化钠固体易溶于水,溶于水时能够放出大量的热;
【实验拓展】氯化钙能和碳酸钠反应生成碳酸钙白色沉淀和氯化钠;
氯化铵能和氢氧化钠反应生成氯化钠、水和氨气,氨气溶于水形成氨水,氨水能使红色石蕊试纸变蓝色;
澄清石灰水中含有氢氧化钙,氢氧化钙能和碳酸氢钠反应生成碳酸钙白色沉淀、氢氧化钠和水.
解答:解:【实验原理】
稀盐酸和氢氧化钠反应的化学方程式为:HCl+NaOH=NaCl+H2O.
故填:HCl+NaOH=NaCl+H2O.
【方案设计】
方案一:稀盐酸和氢氧化钠反应时放出大量的热,锥形瓶中的空气受热膨胀,观察到红墨水向右移动.
故填:右.
方案二:实验操作:向氢氧化钠溶液中滴加几滴酚酞试液,再滴加稀盐酸;
实验现象:溶液由红色变成无色;
实验结论:盐酸与氢氧化钠发生了化学反应.
故填:向氢氧化钠溶液中滴加几滴酚酞试液,再滴加稀盐酸;溶液由红色变成无色.
【评价反思】
因为氢氧化钠固体溶于水放热,使气体体积膨胀,所以观察到红墨水向右移动不足以证明盐酸与氢氧化钠发生了化学反应.
故填:氢氧化钠固体溶于水放热,使气体体积膨胀.
【实验拓展】实验中A、B试剂分别是氯化钙、氯化铵,向NaHCO3溶液中加入氯化钙溶液时,无明显现象,再滴加NaOH溶液时,氢氧化钠和碳酸氢钠反应生成碳酸钠和水,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,因此出现了白色沉淀;
氯化铵的作用是用来检验氢氧根离子是否已经反应掉,用B进行实验的主要操作是:过滤,把滤液置于试管中,在试管口放湿润的红色石蕊试纸,向滤液中加入氯化铵,加热试管,红色石蕊试纸不变色,说明溶液中不存在氢氧根离子,即氢氧化钠已经反应;
如果向碳酸氢钠溶液中加入氢氧化钡溶液,因为氢氧化钡属于碱,能够和碳酸氢钠反应生成白色沉淀碳酸钡,同样可以达到实验目的.
故填:氯化钙、氯化铵;过滤,把滤液置于试管中,在试管口放湿润的红色石蕊试纸,向滤液中加入氯化铵,加热试管;用来检验氢氧根离子是否已经反应掉;氢氧化钡.
稀盐酸和氢氧化钠反应的化学方程式为:HCl+NaOH=NaCl+H2O.
故填:HCl+NaOH=NaCl+H2O.
【方案设计】
方案一:稀盐酸和氢氧化钠反应时放出大量的热,锥形瓶中的空气受热膨胀,观察到红墨水向右移动.
故填:右.
方案二:实验操作:向氢氧化钠溶液中滴加几滴酚酞试液,再滴加稀盐酸;
实验现象:溶液由红色变成无色;
实验结论:盐酸与氢氧化钠发生了化学反应.
故填:向氢氧化钠溶液中滴加几滴酚酞试液,再滴加稀盐酸;溶液由红色变成无色.
【评价反思】
因为氢氧化钠固体溶于水放热,使气体体积膨胀,所以观察到红墨水向右移动不足以证明盐酸与氢氧化钠发生了化学反应.
故填:氢氧化钠固体溶于水放热,使气体体积膨胀.
【实验拓展】实验中A、B试剂分别是氯化钙、氯化铵,向NaHCO3溶液中加入氯化钙溶液时,无明显现象,再滴加NaOH溶液时,氢氧化钠和碳酸氢钠反应生成碳酸钠和水,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,因此出现了白色沉淀;
氯化铵的作用是用来检验氢氧根离子是否已经反应掉,用B进行实验的主要操作是:过滤,把滤液置于试管中,在试管口放湿润的红色石蕊试纸,向滤液中加入氯化铵,加热试管,红色石蕊试纸不变色,说明溶液中不存在氢氧根离子,即氢氧化钠已经反应;
如果向碳酸氢钠溶液中加入氢氧化钡溶液,因为氢氧化钡属于碱,能够和碳酸氢钠反应生成白色沉淀碳酸钡,同样可以达到实验目的.
故填:氯化钙、氯化铵;过滤,把滤液置于试管中,在试管口放湿润的红色石蕊试纸,向滤液中加入氯化铵,加热试管;用来检验氢氧根离子是否已经反应掉;氢氧化钡.
点评:合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
烧碱氢氧化钠是一种重要的化工原料,工业上用电解饱和食盐水的方法制取烧碱,下列物质不可能是电解饱和食盐水产品的是( )
| A、H2 |
| B、Cl2 |
| C、NaOH |
| D、Na2CO3 |
 的离子符号
的离子符号 维生素C(化学式C6H8O6)能促进人体生长发育,增强人体对疾病的抵抗力. 求:
维生素C(化学式C6H8O6)能促进人体生长发育,增强人体对疾病的抵抗力. 求: