题目内容
【题目】已知金属M只有一种化合价,其氧化物为M2O3。为了比较金属M和N的活动性强弱,小龙和小阳分别设计了以下实验。
(1)小龙将金属M和N分别深入硫酸亚铁溶液中,只有M表面有明显变化,写出相关的化学方程式________,可得出金属活动性强弱M_____N。
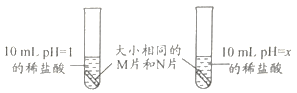
(2)小阳设计了如图实验,则x=______,可通过观察______(填序号)来比较M、N的活动性强弱。
①有无产生气泡 ②产生气泡的快慢 ③产生气泡的多少 溶液颜色是否消失
(3)小龙和小阳经讨论后认为只需一个实验即可比较金属M和N的活动性,可将______(填实验方案),观察到无明显现象,即可得出结论。
【答案】 2M+3FeSO4=====3Fe+M2(SO4)3 > 1 ①② 金属N放入M的盐溶液中(或金属M放入N的盐溶液中)
【解析】本题考查了金属活动性探究。金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来。
(1)金属M只有一种化合价,其氧化物为M2O3,所以M的化合价为+3价,将金属M和N分别深入硫酸亚铁溶液中,只有M表面有明显变化,说明了金属的活动性是M>Fe>N;M与硫酸亚铁发生置换反应生成M的硫酸盐和铁,化学方程式2M+3FeSO4=====3Fe+M2(SO4)3;
(2)酸性的强弱影响金属与酸反应的速度,为了比较两种金属的活动性,酯的强弱程度需要相同,所以x=1;
(3)活动性M>N,金属N放入M的盐溶液中不能发生化学反应,金属M放入N的盐溶液中能发生化学反应。一个实验即可比较金属M和N的活动性,可将金属N放入M的盐溶液中(或金属M放入N的盐溶液中)。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目