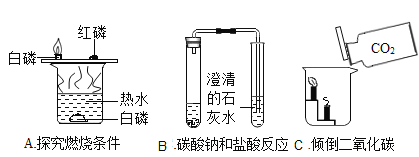
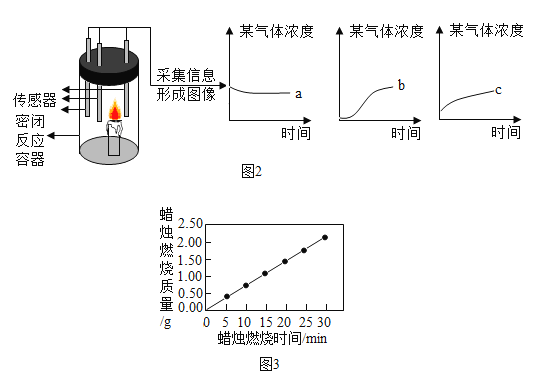
题目内容
【题目】由Mg(OH) 2和MgO 组成的混合物,测得其中含镁元素的质量分数为48%。取该混合物10g,将其投入110g的稀硫酸中恰好完全反应,所得溶液中溶质的质量分数为 ( )
A.12%B.24%C.20%D.30%
【答案】C
【解析】
试题根据质量守恒定律可知,在反应中,镁原子的总质量不变,即反应前镁的量=反应后硫酸镁中镁的量;由镁元素的质量分数和混合物的质量,可计算镁元素的质量,再利用硫酸镁中镁的质量分数,求出硫酸镁的质量,而混合物与酸的质量之和为反应后溶液质量,最后可计算溶质的质量分数。
解,混合物中镁元素的质量为10g×48%=4.8g,
则恰好完全反应后溶液中硫酸镁的质量为4.8g÷![]() ×100%=24g,
×100%=24g,
而反应后溶液质量=10g+110g=120g,
则溶液中溶质的质量分数=![]() ×100%=20%。故选C
×100%=20%。故选C

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】化学课上,老师给同学们做了一个“滴水生火”的趣味实验:将水滴到放有过氧化钠(Na2O2)粉末的脱脂棉上,脱脂棉立即燃烧了起来。此实验激发了大家的学习兴趣,同学们在老师的带领下到实验室进行了一番探究。他们将少量过氧化钠粉末放入试管中,然后加入适量的水,观察到有大量气泡产生,试管壁发热。
(提出问题)过氧化钠与水反应生成了什么物质?
(作出猜想)甲同学:生成氢氧化钠 乙同学:生成碳酸钠 丙同学:生成氢气 丁同学:生成氧气
(1)大家一致认为乙同学的推测不正确,理由是______。
(实验探究)
实验方法 | 实验现象 | 实验结论 |
取一支试管收集生成的气体,堵住试管口,移近酒精灯火焰,点燃 | 无现象 | (2)____ |
另取一支试管收集生成的气体,将带火星的木条伸进试管内 | (3)___ | 有氧气生成 |
(4)_______溶液变红,说明溶液呈碱性
(得出结论)
(5)过氧化钠与水反应的化学方程式为_____,该反应是____(选填“吸热”或“放热”)反应。
(反思拓展)
(6)根据以上实验探究,可知过氧化钠应_____保存。
【题目】实验室对一瓶未知溶质质量分数的H2SO4溶液进行测定,取20.0g硫酸样品于锥形瓶中,逐滴加入16%的NaOH溶液,并对溶液进行pH监测,所得数据如表所示:
滴加NaOH溶液的质量/g | 9.0 | 9.4 | 9.8 | 10.0 | 10.2 |
溶液的pH | 1.8 | 2.1 | 2.6 | 7.0 | 11.4 |
请回答:
(1)当滴加NaOH溶液的质量为9.4g时,溶液中的溶质是________。
(2)计算所测H2SO4溶液中溶质的质量分数。______