题目内容
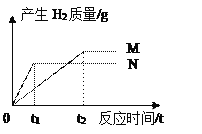
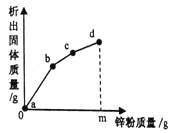
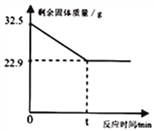
【题目】在实验室加热32.5g二氧化锰和氯酸钾的固体混合物制取氧气直至不再产生气体时,剩余固体物质的质量变化如图所示.
请计算:
(1)完全反应时,生成氧气的质量为_______克。
(2)完全反应后,把剩余固体倒入134.1g蒸馏水中,充分溶解,求所得溶液中溶质的质量分数为___________________。
(3)完全反应后,二氧化锰质量是_______克。
【答案】 9.6 10% 8
【解析】由质量守恒定律可得,生成的氧气的质量为32.5g22.9g=9.6g;
由于是完全反应,所以剩余固体为生成的氯化钾和作催化剂的二氧化锰,设生成9.6g的氧气的同时生成的氯化钾的质量为x
2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
14996
x9.6g
![]()
x=14.9g
充分溶解,所得溶液中溶质的质量分数为![]() ;
;
答:(1)完全反应时,生成氧气的质量为9.6g;完全反应后MnO2的质量为22.9g-14.9g=8g。
(2)完全反应后,把剩余固体倒入134.1g蒸馏水中,充分溶解,求所得溶液中溶质的质量分数约为10%;(3 )完全反应后MnO2的质量为8g。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】某研究小组对自动充气气球(示意图如图1)进行下列探究.
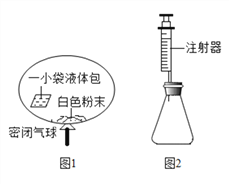
【查阅资料】该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气.
(1)为了检验气体是二氧化碳,可选用____(填试剂名称),反应方程式为_______________。
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈_____性。
探究二:白色粉末成分的探究
【猜想与假设】
甲同学认为是碳酸钙; 乙同学认为是碳酸钠; 丙同学认为是碳酸氢钠。
【设计并进行实验】
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明________同学的猜想不正确。
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:
实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
名称 | 质量/g | ||
① | 碳酸氢钠 | 5 | V1 |
② | 碳酸钠 | 5 | V2 |
③ | 白色粉末 | x | V1 |
实验①的化学方程式为__________;表中x=_____;V1 ____V2(填“>”、“<”或“=”)。
【分析并得出结论】:
(5)白色粉末是_________。
【题目】小鸣同学特别喜欢化学,经常看一些与化学有关的课外书,有一次阅读化学氧自救器的说明书中,看到人呼出气体中的二氧化碳与自救器药罐中的生氧剂(超氧化钾KO2)接触能产生氧气后,对自救器内发生的化学反应原理产生了探究欲望。在老师指导下,小鸣与化学兴趣小组的同学们展开了以下两个实验探究活动,请你也参与。
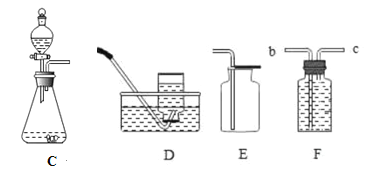
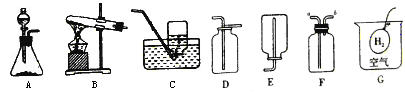
活动Ⅰ:用下图所示的由a、b、c、d组合成的装置和有关药品制取并收集氧气。

活动Ⅱ:探究二氧化碳与超氧化钾反应除生成氧气还生成什么其他物质?
[老师提示]二氧化碳与超氧化钾反应的生成物只有两种,其一是氧气,其二是一种化合物。
[作出猜想]二氧化碳与超氧化钾反应生成的化合物到底是哪种物质?小强作出了以下两种猜想:
①是一种碱;②是一种碳酸盐。
通过对反应物有关的元素组成的分析,小影同学认为猜想_______(填序号)一定是错误的,理由是__________________________________________________________。
[进行实验]同学们通过以下实验验证小强同学的另一个猜想。
实验步骤 | 实验现象 | 实验结论 |
将二氧化碳与超氧化钾反应后的固体_____________ | ___________ | 猜想是正确的,二氧化碳与超氧化钾反应生成的化合物是__________(填名称)。 |
[交流与讨论]
小影认为:二氧化碳与超氧化钾反应的化学方程式_________________________。