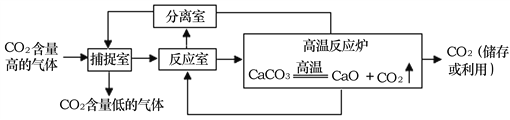
题目内容
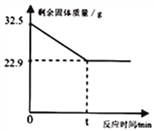
【题目】(题文)相同质量的M、N两种金属,分别与足量的同种稀盐酸反应(M、N在生成物中均为+ 2价),生成氢气质量和反应时间的关系如图所示: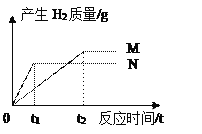
(1)相对原子质量:M_____N(填“>”、“=”、或“<”);
(2)金属活动性:M_____N(填“>”、“=”、或“<”);
(3)消耗盐酸的质量:M_____N(填“>”、“=”、或“<”);
(4)若M为铁,请写出它与盐酸反应的化学方程式_____________。
【答案】 < < > Fe + 2HCl = FeCl2 + H2↑
【解析】产生氢气的快慢与金属活动性有关,金属活动性越强生成的氢气的速率越快;生成氢气的多少与金属的相对原子质量有关,相对原子质量小的生成的氢气多。(1)相对原子质量:M<N;(2)金属活动性:M<N;(3)消耗盐酸的质量:M>N;(4)若M为铁,铁与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为Fe + 2HCl = FeCl2 + H2↑。

练习册系列答案
相关题目
【题目】下列对知识归纳,你认为完全正确的一组是
A.数字含义 | B.节约资源 |
Cu2+:一个铜离子带2个单位正电荷 SO3:三氧化硫中含有3个氧原子
| 废旧金属回收利用 提倡使用乙醇汽油 实验后用剩药品放回原瓶 |
C. 能量变化 | D. 保护环境 |
电解水是将电能转化成化学能 煤燃烧是将化学能转化成热能、光能 使用电池时是化学能转化成电能 | 小区设置废旧电池回收箱 焚烧秸秆以利于耕作 工业“三废”处理达标后排放 |
A. A B. B C. C D. D