题目内容
某烧杯中加入12.5g含杂质的石灰石,与100g稀盐酸恰好完全反应(杂质不与盐酸反应也不溶于水),称得烧杯中物质的总质量减少了4.4g.求:
(1)石灰石含碳酸钙的质量分数.
(2)反应后溶液中溶质的质量分数.
(1)石灰石含碳酸钙的质量分数.
(2)反应后溶液中溶质的质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:由于反应放出气体二氧化碳,因此造成反应后物质质量减小,利用质量质量守恒定律,求出反应放出二氧化碳质量;根据反应的化学方程式,由二氧化碳气体的质量求出反应反应的碳酸钙质量和生成的氯化钙的质量;再根据质量守恒定律求得反应后溶液的质量,据此分析解答.
解答:解:由题意可知:生成CO2的质量:4.4g;
设反应的碳酸钙质量是x,反应生成的氯化钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
=
=
x=10g y=11.1g
(1)石灰石含碳酸钙的质量分数为
×100%=80%.
(2)反应后所得溶液中的质量为:10g+100g-4.4g=105.6g;
反应后所得溶液中溶质的质量分数:
×100%=10.5%;
答:(1)石灰石含碳酸钙的质量分数为80%.(2)应后所得溶液中溶质的质量分数10.5%.
设反应的碳酸钙质量是x,反应生成的氯化钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
| 100 |
| x |
| 111 |
| y |
| 44 |
| 4.4g |
x=10g y=11.1g
(1)石灰石含碳酸钙的质量分数为
| 10g |
| 12.5g |
(2)反应后所得溶液中的质量为:10g+100g-4.4g=105.6g;
反应后所得溶液中溶质的质量分数:
| 11.1g |
| 105.6g |
答:(1)石灰石含碳酸钙的质量分数为80%.(2)应后所得溶液中溶质的质量分数10.5%.
点评:此题是对化学方程式计算的考查,解题的关键是要知道反应后物质的减少量是生成二氧化碳的质量.

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目

 ABCDEF六种物质中,A是组成最简单的碳氢化合物,BDE为常见的气体,C 是由两种元素组成的常见的液体,F是一种不稳定的化合物,易分解,且它们之间存在如图所示的转化关系,请据图回答下列问题:
ABCDEF六种物质中,A是组成最简单的碳氢化合物,BDE为常见的气体,C 是由两种元素组成的常见的液体,F是一种不稳定的化合物,易分解,且它们之间存在如图所示的转化关系,请据图回答下列问题: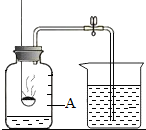 空气是一种宝贵的资源.用如图所示装置,测定空气里氧气的含量.实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧.待红磷熄灭后,发现红磷还有剩余,冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到图中A位置.
空气是一种宝贵的资源.用如图所示装置,测定空气里氧气的含量.实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧.待红磷熄灭后,发现红磷还有剩余,冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到图中A位置.