题目内容
【题目】研究物质的溶解对于生产、生活有着重要意义。
下面表一是硝酸钾的部分溶解度数据。
表一:
温度(°C) | 20 | 40 | 60 | 80 |
溶解度(g/100g水) | 31.6 | 63.9 | 110 | 169 |
(1)由上面表一中数据可知硝酸钾的溶解度随温度升高而______________________(选填“变大”或“变小”)。60℃时硝酸钾饱和溶液中,溶质与溶剂的质量比为________________ (最简整数比) ,能将该饱和溶液转化为不饱和溶液的一种方法是_________________(写出一种即可)
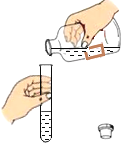
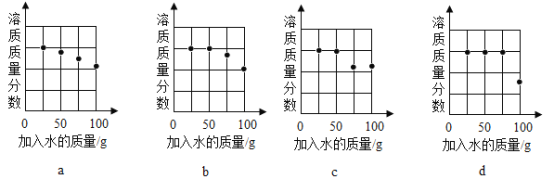
(2)探究20℃时配制硝酸钾溶液过程中,溶质质量分数与加入水的质量关系。
向硝酸钾中分批加水,充分搅拌,现象如下图所示:

下列坐标图中,符合实验结果的描点可能是______________________________ (选填编号) 。
(3)取等质量甲和乙两种物质(均不含结晶水)进行如图所示实验,最终烧杯中析出固体的质量甲小于乙。
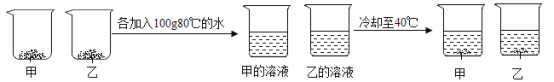
则40℃时,甲的溶解度___________ (选填 “大于”“等于”或“小于”)乙的溶解度,根据本实验结果能否判断40℃~80℃间,甲、乙哪种物质的溶解度变化受温度影响更大___ (选填“能”或“不能”)。
(4)根据表一的数据,20℃时,将50gKNO3固体放入100g 水中充分溶解,所得溶液中溶质的质量分数为________________________; (计算结 果精确到0.1%).
【答案】变大 11:10 升高温度 bd 大于 不能 24.0%
【解析】
(1)由表一中数据可知硝酸钾的溶解度随温度升高而变大;
60℃时硝酸钾饱和溶液中,溶质与溶剂的质量比为:110g:100g=11:10;
由于硝酸钾的溶解度随温度升高而变大,故能将该饱和溶液转化为不饱和溶液的一种方法有升高温度,或者可以增加溶剂的质量;
(2)由图可知,第一只烧杯和第二只烧杯的底部均有未溶解的硝酸钾固体,故20℃时,它们均为饱和溶液,第一只烧杯和第二只烧杯中溶质的质量分数相等,继续加25g水至第三只烧杯中,第三只烧杯中的硝酸钾完全溶解,在20℃时,可能恰好是饱和溶液,也可能是不饱和溶液,如20℃时,第三只烧杯中是饱和溶液,则溶质的质量分数与第一只烧杯、第二只烧杯中溶液的溶质质量分数相同,如20℃时,第三只烧杯中是不饱和溶液,则溶质的质量分数减小,继续加25g水至第四只烧杯中,与第三只烧杯相比,溶质质量不变,溶液质量增加,故溶质质量分数减小。
故选bd。
(3)取等质量甲和乙两种物质(均不含结晶水)进行如图所示实验,最终烧杯中析出固体的质量甲小于乙,说明40℃时,甲物质在100g溶剂里达到饱和状态时所溶解的质量大于乙,故40℃时,甲的溶解度大于乙的溶解度。
根据本实验结果不能判断40℃~80℃间,甲、乙哪种物质的溶液饱和,不能判断溶解度变化受温度影响哪种更大;
(4)根据表一的数据,20℃时,100g水能溶解31.6g硝酸钾,故20℃时,将50gKNO3固体放入100g 水中充分溶解,所得溶液为该温度下的饱和溶液,则所得溶液中溶质的质量分数为![]() 。
。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案【题目】某校学习小组利用石灰石与稀盐酸反应,收集并测定 CO2 的体积(如图所示)。实验数 据在相同温度、相同压强条件下测定:
时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
注射器读数/mL | 60.0 | 85.0 | 88.0 | 89.0 | 89.5 | 89.8 | 89.9 | 90.0 | 90.0 | 90.0 |
以下说法错误的是( )
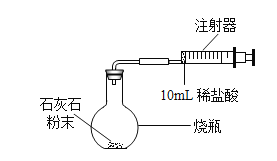
A.实验前向外拉注射器活塞,松开后活塞回到原位,则装置气密性良好
B.实验中需快速地将 10mL 稀盐酸推入烧瓶内
C.反应的化学方程式为 CaCO3+2HCl═CaCl2+H2O+CO2↑
D.根据以上数据综合分析,最终生成CO2的体积是 30mL