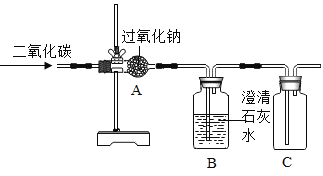
题目内容
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线。下列叙述正确的是( )

A.t1℃时,乙物质的溶解度大于丙
B.t2℃时,20g丙能溶解于50g水中形成70g溶液
C.若要将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D.将t3℃时甲、乙、丙三种物质的饱和溶液降温至t2℃,所得溶液溶质质量分数的大小关系为乙>甲=丙
【答案】C
【解析】
A、由图可知,t1℃时,乙物质的溶解度小于丙,选项错误;
B、t2℃时,丙物质的溶解度是30g,所以20g丙不能溶解于50g水中,最多可溶解15g丙,形成65g溶液,选项错误;
C、若要将N点的甲溶液(不饱和溶液)转变为M点的甲溶液(饱和溶液),可采取恒温蒸发溶剂的方法,选项正确;
D、t3℃时,将甲、乙、丙三种物质的饱和溶液降温到t2℃,甲、乙的溶解度减小,析出晶体,得t2℃的饱和溶液。![]() ,但是t2℃时,乙的溶解度比甲的大,所得溶液溶质的质量分数:乙>甲;降温时,丙的溶解度变大,溶质不析出,溶液中溶质的质量分数不变,等于t3℃时饱和溶液溶质的质量分数,丙在t3℃时的溶解度比甲在t2℃时的溶解度小,所得溶液中溶质质量分数甲>丙,降温到t2℃三种物质所得溶液溶质的质量分数大小关系是乙>甲>丙,选项错误。
,但是t2℃时,乙的溶解度比甲的大,所得溶液溶质的质量分数:乙>甲;降温时,丙的溶解度变大,溶质不析出,溶液中溶质的质量分数不变,等于t3℃时饱和溶液溶质的质量分数,丙在t3℃时的溶解度比甲在t2℃时的溶解度小,所得溶液中溶质质量分数甲>丙,降温到t2℃三种物质所得溶液溶质的质量分数大小关系是乙>甲>丙,选项错误。
故选C。

【题目】为测定久置于空气中的氢氧化钠样品的变质程度,某化学活动小组称取该固体样品6.5g放入锥形瓶中,加水溶解,配成50g溶液,再向锥形瓶中滴加稀硫酸,现部分数据如图表:
加入稀硫酸的质量/g | 40 | 65 | 75 |
产生气体的质量/g | 1.1 | 2.2 | 2.2 |
(1)6.5g样品与稀硫酸完全反应产生气体的质量是____g。
(2)求6.5g样品中碳酸钠的质量____(写出具体计算过程)。
(3)分析图像:加入稀硫酸时中间有一段锥形瓶内溶液质量增加的幅度比两侧小,原因是___。
(4)以上三次实验数据只有一次表示反应恰好完全,则图象中a的数值是_____。