题目内容
【题目】为测定久置于空气中的氢氧化钠样品的变质程度,某化学活动小组称取该固体样品6.5g放入锥形瓶中,加水溶解,配成50g溶液,再向锥形瓶中滴加稀硫酸,现部分数据如图表:
加入稀硫酸的质量/g | 40 | 65 | 75 |
产生气体的质量/g | 1.1 | 2.2 | 2.2 |
(1)6.5g样品与稀硫酸完全反应产生气体的质量是____g。
(2)求6.5g样品中碳酸钠的质量____(写出具体计算过程)。
(3)分析图像:加入稀硫酸时中间有一段锥形瓶内溶液质量增加的幅度比两侧小,原因是___。
(4)以上三次实验数据只有一次表示反应恰好完全,则图象中a的数值是_____。

【答案】2.2 5.3 加入稀硫酸时中间有一段是碳酸钠和稀硫酸反应生成二氧化碳逸出,两侧反应没有气体生成 65
【解析】
(1)加入硫酸气体质量不再增加可知,第二组数据中硫酸和锥形瓶中溶液的溶质恰好完全反应,所以生成的气体的质量为2.2g;
(2)解:设6.5g样品中碳酸钠的质量为x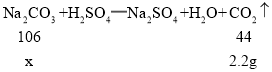
![]()
x=5.3g
答:样品中碳酸钠的质量为5.3g;
(3)加入稀硫酸时中间有一段锥形瓶内溶液质量增加的幅度比两侧小,原因是加入稀硫酸时中间有一段是碳酸钠和稀硫酸反应生成二氧化碳逸出,两侧加入稀硫酸时没有气体生成;
(4)根据第一组数据和第二组数据可知,25g稀硫酸对应1.1g的二氧化碳,所以开始没有气体对应硫酸的质量为40g-25g=15g,所以a=50g+15g=65g。

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】为测定某样品中锌的质量分数,取10g此样品,分五次向其中加入稀硫酸使之充分反应(假设锌的样品中杂质不与稀硫酸反应,且不溶于水),每次加入的稀硫酸质量及测定剩余固体的质量,记录数据如下表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 10 | 10 | 10 | 10 | 10 |
剩余固体质量/g | 8.4 | 6.8 | 5.2 | 3.6 | 3.6 |
请认真分析表中的数据,回答下列问题:
(1)表示样品与稀硫酸恰好完全反应的是上表中第________次操作;
(2)计算样品中锌的质量分数; ____
(3)计算实验中所用稀硫酸的溶质质量分数。 ______