题目内容
【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2 和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料N2和H2。
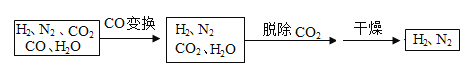
(1)在使用铜催化剂和加热条件下,半水煤气主要成分间发生反应实现了 CO 变换,其化学方程式为:________。
(2)吸收法是脱除CO2的方法之一。已知:
溶质 | Na2CO3 | K2CO3 |
20℃1L饱和溶液中溶质的物质的量mol | 2.0 | 8.0 |
溶质价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3溶液作吸收液,其优点是_;缺点是_。如果选择K2CO3溶液作吸收液,用某种方法可以降低成本,写出这种方法涉及的化学方程式:_。
(3)将一定体积半水煤气依次通过装置Ⅰ~Ⅴ(最后通入氮气确保反应、吸收完全),可以 测定其中H2以及 CO 的物质的量。
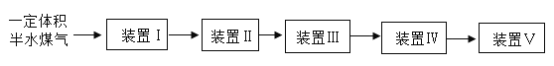
可供选用的装置如下所示(省略夹持仪器):
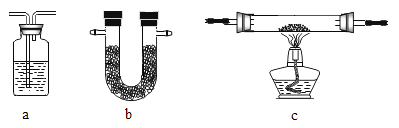
为装置Ⅰ~Ⅴ选择合适的装置与试剂:
装置 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
a | a | _ | _ | b | |
试剂 | _ | 浓硫酸 | CuO | _ | _ |
装置Ⅰ、Ⅱ的作用是____________。要确定半水煤气中H2物质的量,应测量的数据是______。
【答案】![]() 价格便宜 吸收二氧化碳的能力差
价格便宜 吸收二氧化碳的能力差 ![]() 氢氧化钠溶液 c b 无水硫酸铜 氢氧化钠固体 除去半水煤气中的二氧化碳和水蒸气 装置Ⅳ增加的质量
氢氧化钠溶液 c b 无水硫酸铜 氢氧化钠固体 除去半水煤气中的二氧化碳和水蒸气 装置Ⅳ增加的质量
【解析】
(1)在使用铜催化剂和加热条件下,半水煤气主要成分一氧化碳与水反应生成二氧化碳和氢气,实现了 CO 变换,其化学方程式为:![]() 。
。
(2)碳酸钠比碳酸钾价格便宜,但饱和溶液条件下,碳酸钠溶液浓度比碳酸钾小,吸收二氧化碳的能力差;碳酸钾吸收二氧化碳生成碳酸氢钾,加热碳酸氢钾可以得到碳酸钾,同时生成水和二氧化碳,再循环利用,反应方程式为:![]() 。
。
(3)先要用氢氧化钠溶液除去半水煤气中的二氧化碳,然后干燥,通过灼热的氧化铜,氢气与灼热的氧化铜反应生成铜和水,一氧化碳与灼热的氧化铜反应生成铜和二氧化碳,再通过无水硫酸铜吸收生成的水,最后用氢氧化钠固体吸收生成的二氧化碳,通过测定生成得到水和二氧化碳的质量,来确定半水煤气中H2以及CO的物质的量;故有:
装置 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
a | a | c | b | b | |
试剂 | 氢氧化钠溶液 | 浓硫酸 | CuO | 无水硫酸铜 | 氢氧化钠固体 |
装置Ⅰ、Ⅱ的作用是除去半水煤气中的二氧化碳和水蒸气。要确定半水煤气中H2物质的量,应测量的数据是装置Ⅳ增加的质量。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】甲醛(CH2O) 为无色有刺激性气味的气体,极易溶于水,是重要的工业原料。由于甲醛影响人体健康,国家标准规定室内甲醛浓度不高于0.08 mg/m。下面介绍几种吸收甲醛的方法。
活性炭包活性炭内部有大量细微孔道,可吸附甲醛。
空气净化器其内置主要有电机和滤网。电机可加快抽入气体的循环流动速度。滤网除活性炭滤网外,还有静电驻极过滤网、光触媒滤网等。静电驻极过滤网靠静电力捕获带电微粒,但不能捕获甲醛。光触媒滤网在紫外线照射下产生氧化能力极强的物质,该物质可杀菌和分解甲醛等有机污染物。
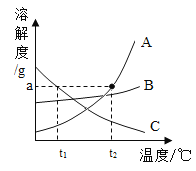
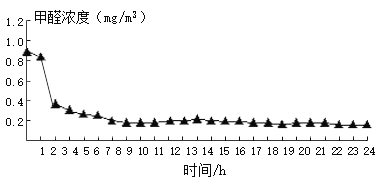
植物某小组在3个密闭容器内分别放入吊兰、绿萝和芦荟,测定0 ~ 24 h甲醛的浓度,计算不同植物对甲醛的去除率(见表),比较其吸收效果,并绘制了吊兰的吸收曲线(如图)。柚子皮和菠萝不具有吸附性,也不与甲醛反应,常温下只能靠自身的气味掩盖甲醛的味道。
吊兰 | 绿萝 | 芦荟 | |
0 h时甲醛的 浓度(mg/m3) | 0.88 | 0.80 | 1.13 |
24 h时甲醛的 浓度(mg/m3) | 0.13 | 0.07 | 0.19 |
去除率(%) | 85.2 | 91.3 | 83.2 |
以上方法效果不一,可根据不同情况选用适合的方法。
依据文章内容,回答下列问题。
(1)甲醛(CH2O) 属于______(填序号,下同)。
A 混合物
B 化合物
C 氧化物
(2)空气净化器吸收甲醛比活性炭包效率高的原因是______(答1条即可)。
(3)依图分析,吊兰吸收效率最高的时间是______。
A 0 ~ 1 h
B 1 ~ 2 h
C 7 ~ 8 h
(4)依表判断,吸收效果最好的植物是______。
(5)下列说法正确的是______。
A 甲醛是重要的工业原料,但使用时需考虑其对环境的影响
B 空气净化器的每层滤网都可以吸收甲醛
C 本实验中,3种植物都不能使密闭容器内甲醛含量降低至国家标准以下
D 柚子皮和菠萝吸收甲醛的效果较好